
题目列表(包括答案和解析)
4.已知某温度下0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),则下列关系中一定正确的是
A.c(Na+)=c(HB-)+2c(B2-)+c(OH-) B.c(Na+)=0.1 mol·L-1≥c(B2-)
C.c(H+)·c(OH-)=10-14 D.溶液的pH=1
3.将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH4+):c(NO3-) =l:1,可采取的措施是
A.加入适量的NH4Cl B.加入适量的氨水,使溶液的pH值等于7
C.加入适量的HNO3,抑制NH4+水解 D.加入适量的NaOH使溶液的pH值等于7
2.在一定条件下发生下列反应,其中属于盐类水解反应的是
A.NH4++2H2O NH3·H2O+H3O+ B.HCO3-+ H2O
NH3·H2O+H3O+ B.HCO3-+ H2O H3O+ + CO32-
H3O+ + CO32-
C.HS-+H+== H2S D.Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
1.下列物质的稀溶液中不存在除水以外的其他分子的是:
A.KHCO3 B.KCl C.HF D.NH4Cl
20.(8分)已知氢氧化镁饱和溶液中存在下列平衡Mg(OH)2 (s) Mg2+(aq)+2OH-(aq),且Mg2+和OH-的物质的量浓度存在下列关系:c(Mg2+)•
c(OH-)2=Ksp,Ksp是一常数。
Mg2+(aq)+2OH-(aq),且Mg2+和OH-的物质的量浓度存在下列关系:c(Mg2+)•
c(OH-)2=Ksp,Ksp是一常数。
某学生在室温下用纯水制备了一份氢氧化镁饱和溶液,测得溶液的pH为10。
(1)用上述测定数据计算在室温下时氢氧化镁的溶解度(用mol·L-1单位表示)。
(2)计算在室温下氢氧化镁的Ksp。
(3)计算室温时在0.010 mol·L-1 NaOH中氢氧化镁的溶解度(用mol·L-1单位表示)。
(4)室温下下将10g Mg(OH)2和100mL 0.100 mol·L-1 HCl的混合并充分搅拌,计算该混合体系中达平衡时溶液的c(OH-)。
19.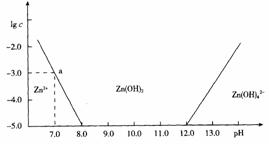 (10分)如图:横坐标为溶液的pH值,
(10分)如图:横坐标为溶液的pH值,
纵坐标为Zn2+离子或Zn(OH)42–离子物
质的量溶液的对数,回答下列问题。
(1)往ZnCl2溶液中加入足量的氢氧
化钠溶液,反应的离子方程式可
表示为:
。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是
(4)往1L 1.00mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol(精确至小数点后2位)
(5)25℃时,PbCl2固体在盐酸中的溶解度如下:
|
c(HCl)/(mol·L–1) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
c (PbCl2)/( 10–3mol·L–1) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
18.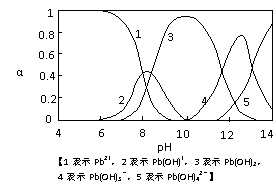 (8分)水体中重金属铅的污染方向问题
(8分)水体中重金属铅的污染方向问题
备受关注。水溶液中铅的存在形态主要
有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)-、
Pb(OH)42-,各形态的浓度分数α随溶液
pH变化的关系如图所示:
(1)Pb(NO3)2溶液中,c(NO3-)/c(Pb2+)
2(填“>”、“=”、“<”=);
往该溶液中滴入氯化铵溶液后,
c(NO3-)/c(Pb2+)增加,可能的原因
是 。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有 ,pH=9时主要反应的离子方程式为 。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
|
离子 |
Pb2+ |
Cu2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/(mol·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/(mol·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是
。(4)如果该脱铅剂(用EH)脱铅过程中主要发生的反应为:2EH(s)+Pb2+ E2Pb(s)+2H+
E2Pb(s)+2H+
则脱铅的最合适pH范围为 (填代号)。
A 4-5 B 6-7 C 9-10 D 11-12
17.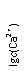
 (10分)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材 料,其常用的制备方法有两种:
(10分)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材 料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到 Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+_______+________
②5Ca(OH)2+3H3PO4=_________________________________________
(2)与方法A相比,方法B的优点是________________________________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是__________
___________________________________________________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是_________________(填化学式)。
(5)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因______________________________________________________
____________________________________________________________________。
16.(4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的离子方程式:
(2)白色固体转化成黑色固体的原因是:
15.已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向l L0.2 mol·L-1HF溶液中加入1L0.2 mol·L-1CaCl2溶液,则下列说法中正确的是
A.25℃时,0.1 mol·L-1HF溶液中pH=l B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生 D.该体系中,Ksp(CaF2)=1/Ka(HF)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com