
题目列表(包括答案和解析)
11.常温下,物质的量浓度均为0.1mol·L-1的两溶液HA、BOH。其中HA溶液的pH > 1,BOH溶液中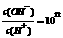 ,则下列有关说法正确的是
,则下列有关说法正确的是
A.HA溶液中水的电离程度大于BOH溶液中水的电离程度
B.将HA、BOH溶液稀释相同的倍数,pH值变化前者大于后者
C.若两溶液混合时:V(BOH) ≥ V(HA) ,则混合液中必有c(B+)>c(A-)
D.将HA、BOH混合所得pH=7的溶液中必有c(B+)=c(HA)+c(A- )
10.现有常温下的四份溶液:①0.01mol/LCH3COOH;②0.01mol/LHCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②③混合,若有pH=7,则消耗溶液的体积:②>③
C.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
D.将①④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
9.常温时,以下四种溶液pH最小的是(设等体积混合后溶液的总体积为原来的2倍)
A.0.01mol·L-1醋酸溶液
B.0.01mol·L-1醋酸与0.02mol·L-1NaOH溶液的等体积混合液
C.0.03mol·L-1醋酸与0.01mol·L-1NaOH溶液的等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液的等体积混合液
8.有机物HIn(In-为原子团)在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn (溶液)  H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol/L的下列溶液 (1)盐酸 (2)NaOH溶液 (3)NaCl溶液 (4)NaHSO4溶液 (5)NaHCO3溶液 (6)氨水,其中能使指示剂显红色的是
A.(1)(4)(5) B.(2)(5)(6) C.(1)(4) D.(2)(3)(6)
7.用pH试纸测定某氨基酸溶液的pH,如果先将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,溶液pH的测得值为8,则该氨基酸溶液的实际pH
A.大于8 B.小于8 C.等于8 D.小于7
6.常温下,某溶液中由水自身电离产生的H+、OH-,其浓度满足c(H+)·c(OH-)=10-24。该溶液中一定能够大量存在的离子组是
A.Ba2+、Na+、Cl-、NO3- B.K+、Na+、AlO2-、Br-
C.K+、NH4+、HSO3-、CO32- D.Na+、Mg2+、Cl-、I-
5.某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的 NaOH溶液中,由水电离出的c(H+)•c(OH-) = 10-22,则该探究小组在该温度下测得0.01mol/L的 NaOH溶液的pH值应为
A.13 B.12 C.11 D.10
4.25 ℃时,水的电离达到平衡:H2O  H++OH-;DH>0,下列叙述正确的是
H++OH-;DH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
3.经测定,液态BrF3在20ºC时导电性很强,说明该化合物在液态时发生了电离,存在阴阳离子。其他众多实验证实,存在一系列有明显离子化合物倾向的盐类,如KBrF4,(BrF2)2SnF6,ClF3·BrF3等,由此推断液态BrF3电离时的阴阳离子是
A.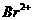 和
和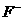 B.
B.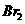 和
和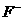 C.
C.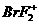 和
和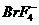 D.
D.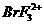 和
和
2.水的电离过程为H2O H++OH-,在不同温度下水的离子积常数为:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。对水的下列叙述正确的是
H++OH-,在不同温度下水的离子积常数为:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。对水的下列叙述正确的是
A.c(H+)随着温度的升高而降低 B.在35℃时,c(H+)>c(OH-)
C.水的电离程度(25℃)>(35℃) D.水的电离是吸热的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com