
题目列表(包括答案和解析)
9.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是:
A.放电时,LiMn2O4发生氧化反应 B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应 D.充电时,阳极反应为:Li++e-==Li
8..我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O==4Al(OH)3, 下列说法不正确的是:
A.正极反应式为:O2+2H2O+4eˉ==4OHˉ
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用36502119
7.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+):
 A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D 电解后,电解槽底部的阳极泥中只有Cu和Pt
6.
 (2007上海)某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是:
(2007上海)某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是:
(A)铅笔端作阳极,发生还原反应 (B)铂片端作阴极,发生氧化反应
(C)铅笔端有少量的氯气产生 (D)a点是负极,b点是正极
5.(2008广东卷)下列有关金属腐蚀与防护的说法正确的是:
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
4.(2007天津)天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6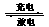 CoO2+LiC6,下列说法正确的是:
CoO2+LiC6,下列说法正确的是:
(A)充电时,电池的负极反应为LiC6-e- = Li++C6
(B)放电时,电池的正极反应为CoO2+Li++e- = LiCoO2
(C)羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
(D)锂离子电池的比能量(单位质量释放的能量)低
3.(2007年高考全国理综卷I)以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出Cu的质量为:
(A)0.64 g (B)1.28 g (C)2.56 g (D)5.12 g
2.(2007年高考海南化学卷,电解)目前下列工艺过程没有直接使用离子交换技术的是:
(A)硬水的软化 (B)电解饱和食盐水制备NaOH
(C)电渗析淡化海水 (D)海水中提取金属Mg
1.(2007年高考广东化学卷,原电池)为了避免青铜器生成铜绿,以下方法正确的是:
(A)将青铜器放在银质托盘上 (B)将青铜器保存在干燥的环境中
(C)将青铜器保存在潮湿的空气中 (D)在青铜器的表面覆盖一层防渗的高分子膜
14.(14分)钢铁工业是国家工业的基础。请回答钢铁冶炼.腐蚀.防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
____________________________________________ 。
(2)铁是一种重要的催化剂,请写出铁在有机反应中做催化剂的化学方程式:
____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
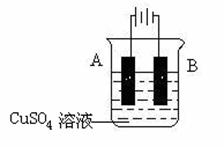
请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式
是 。
② 若电镀前铁.铜两片金属质量相同,电镀完成后将它们取出洗净.烘干.称量,
二者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
2010年高考总复习化学培优补差训练(19)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com