
题目列表(包括答案和解析)
12. 取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)
=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正确的是
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)
=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正确的是
A.常温下,0.0025mol/LNaOH溶液 pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,
PbI2的Ksp减小
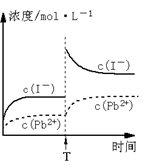
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI
浓溶液,离子浓度变化如右图所示。
D.本次实验测得的t℃ PbI2的Ksp=4×10-9
第Ⅱ卷(非选择题 共78分)
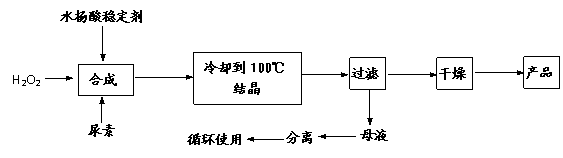
13(12分).过氧化尿素[CO(NH2)2·H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:
 试回答下列问题:
试回答下列问题:
(1)实际生产中需控制n(H2O2)∶n[CO(NH2)2]=1.2∶1,并控制合成温度在25-30℃,其主要原因是 ▲ 。
(2)从母液中分离出H2O2和尿素,采用的操作是 ▲ 。
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol/L的硫酸,然后用0.2000mol/LKMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KmnO4溶液与尿素不反应)。
①KMnO4溶液应盛放在 ▲ 式(选填:“酸”、“碱”)滴定管中。
②完成并配平方程式:MnO4-+H2O2+H+=Mn2++H2O+
③根据滴定结果,可确定产品中活性氧的质量分数为: ▲ 。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 ▲ . (选填:“偏高”、“偏低”或“不变”)。
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为▲ 。
14(12分).由磷矿石、石英、氯化氢等为原料生产白炭黑(SiO2·nH2O)、磷及甲醇,下列工艺过程原料综合利用率高,废弃物少。
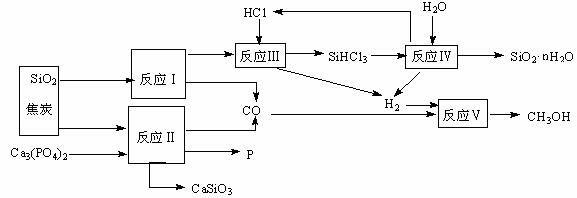
(1)上述反应中,属于置换反应的是 ▲ (选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(2)已知SiHCl3的沸点为33.0℃,提纯SiHCl3适宜的方法是 ▲ 。
(3)高温下进行的反应Ⅱ的化学方程式为: ▲ ;固体废弃物CaSiO3可用于 ▲ 。
(4)反应Ⅲ需在高温、隔绝氧气和无水条件下进行,其原因是 ▲ 。
(5)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 ▲ 。
15(10分).钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用。但在较高温度下,钛可与多种单质和化合物发生反应。工业上冶炼钛主要以钛铁矿、金红石(含TiO2大于96%)等为原料生产。
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
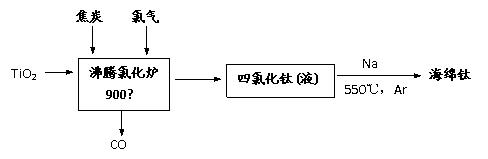 ①沸腾氯化炉中反应:TiO2(s) +2Cl2 (g)=TiCl4(l) + O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S =57.74J/K) ▲ (选填:“能”或“不能”)。
①沸腾氯化炉中反应:TiO2(s) +2Cl2 (g)=TiCl4(l) + O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S =57.74J/K) ▲ (选填:“能”或“不能”)。
②已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol
Na(s) = Na(l) △H =2.6 kJ/mol
则TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = ▲ kJ/mol
③海绵钛破碎后用0.5%-1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的
▲ 。
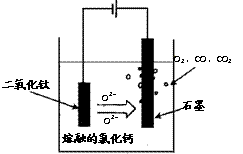 (2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,阴极获得钛可能发生的反应或电极反应为: ▲ 。
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体是 ▲ 。
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为:
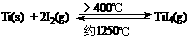 ,下列说法正确的是 ▲ 。
,下列说法正确的是 ▲ 。
(a) 该反应正反应为的△H>0
(b) 在不同温度区域,TiI4 的量保持不变
(c) 在提纯过程中,I2 的量不断减少
(d) 在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
11.下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-) >c(H2C2O4)>c(C2O42-)
B.NaHCO3溶液:c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
C.25℃时,pH=9、浓度均为0.1 mol/L的NH3·H2O、NH4Cl混合溶液:
c(NH4+)+c(H+)>c(NH3·H2O)+c(OH-)
D.0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
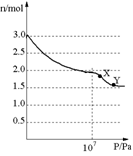
10.将3molNO放入密闭容器中,50℃时恒温加热,然后加压,气体总物质的量随压强变化如右图所示,下列说法正确的是
A.在X、Y两点,反应速率υ(X)=υ(Y)
B.压强小于107Pa,主要发生的反应为:2NO=N2+O2
C.X点→Y点,可能发生的反应为:2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
D.整个过程中可能发生的反应为:3NO=N2O+NO2, 2NO2(g) N2O4(g)
N2O4(g)
9.下列离子方程式书写不正确的是
A.用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
B.碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2:
4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O
 D.用硫酸酸化的桔红色的重铬酸钾(K2 Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:
D.用硫酸酸化的桔红色的重铬酸钾(K2 Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:
2Cr2O72-+ 3C2H5OH + 16H+ → 4Cr3+ + 3CH3COOH + 11H2O
8.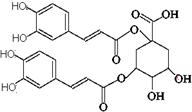 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
A.分子中含有4个手性碳原子
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与11molNaOH反应
7.下列化学实验事实解释正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解,是因为铜可直接与1mol/L稀硫酸反应
B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
C.相同物质的量浓度乙酸铅溶液导电能力比乙酸钙弱得多,说明乙酸铅属于非电解质
D.浓NH4Cl溶液处理过的舞台幕布不易着火,是因为处理后幕布质量增加,着火点升高
6.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
|
物质 编号 |
物质转化关系 |
甲 |
乙 |
丙 |
丁 |
|
① |
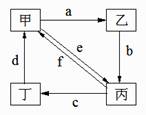 |
Cu |
CuO |
CuCl2 |
Cu(NO3)2 |
|
② |
Na2CO3 |
NaOH |
NaHCO3 |
CO2 |
|
|
③ |
(NH4)2SO3 |
CaSO3 |
SO2 |
NH4HSO3 |
|
|
④ |
Al(OH)3 |
Al2O3 |
NaAlO2 |
AlCl3 |
A.①②③④ B.①②③ C.①③④ D.②④
5.香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等, X、Z位于同主族,Y、Z、R、T位于同周期, R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法不正确的是
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Y>Z
D.XR2、WR2两化合物中R的化合价相同
4.在下列各组溶液中,离子一定能大量共存的是
A.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I-
B.常温下,pH=1的溶液:Fe3+、Na+、NO3-、SO42-
C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42-
D.含0.1mol/LNH4Al(SO4)2·12H2O的溶液:K+、Ca2+、NO3-、OH-
3.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.3.6g碳与3.36LO2一定条件下恰好完全反应,生成CO分子数一定为0.3 NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.25℃时, 0.15mol/L的Na2CO3溶液中,Na+数目为0.3NA
D.标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com