
题目列表(包括答案和解析)
9.已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它和A、B、C可分别形成电子总数相等的三种分子。请回答:
(1)写出工业生产中BD3与氧气反应的化学方程式
(2)你认为B、C、D元素形成的化合物之间能否 (选填“能”或“不能”)发生下面的反应:BC+BD3→DBC2+D2C,理由是
(3)由A、C、D三种元素组成的化合物A2D6C在一定条件下可以转化为A2D4C,写出实现该转化的化学方程式
(4)①恒温恒压下,在一定体积可变的密闭容器中发生下列反应:
4AC(g)+2 BC2(g) 4 AC2(g)+B2(g)
4 AC2(g)+B2(g)
在上述条件下,向容器中充入AC和 BC2各1mol达平衡时,生成AC2和B2共a mol,则AC的转化率是 (用含a的代数式表示)。
②若维持温度不变,在一个与①反应前的体积相同且容积固定的密闭容器中发生①中所述的化学反应,开始时仍向容器中充入AC和 BC2各1mol,达平衡时生成AC2和B2共b mol,将b与①中的a进行比较,则a b(填“>”、“<”或“不能确定”)。
8.某温度下,在一容积可变的容器中,反应
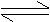 2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
7.在一恒定的容器中充入2molA和1molB发生反应:2A(气)+B(气)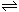 xC(气),到平衡后,C的体积分数为W%:若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则比值为( )
xC(气),到平衡后,C的体积分数为W%:若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则比值为( )
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
6.在一密闭容器中进行2SO2+O2  2SO3三氧化硫的反应,己知反应过程中某一时刻的数据是: SO2、O2、SO3的浓度分别是0.2mol/L、0.1mol/L、 0.2mol/L,当达到平衡时可能数据是( )
2SO3三氧化硫的反应,己知反应过程中某一时刻的数据是: SO2、O2、SO3的浓度分别是0.2mol/L、0.1mol/L、 0.2mol/L,当达到平衡时可能数据是( )
A.SO2 0.4mol/L B.SO2 0.25mol/L
C.SO2 SO3均为0.15mol/L D.SO3 0.4mol/L
5.在恒温、恒容的条件下,有反应2A(气)+2B(气)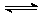 C(气)+3D(气),现从两条途径分别建立平衡。途径I:A、B的起始浓度均为2mol·L-1;途径II:C、D的起始浓度分别为2mol/L和6mol/L;则以下下叙述正确的是( )
C(气)+3D(气),现从两条途径分别建立平衡。途径I:A、B的起始浓度均为2mol·L-1;途径II:C、D的起始浓度分别为2mol/L和6mol/L;则以下下叙述正确的是( )
A.两途径最终达到平衡时,体系内混合气的百分组成相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径I的反应速率v(A)等于途径II的反应速率v(A)
D.达平衡时,途径I所得混合气的密度为途径II所得混合气密度的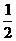
4.
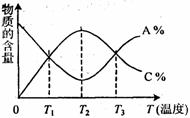 已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到化学平衡
C.升高温度,平衡会向正反应方向移动
D.该反应的正反应是吸热反应过
3.在一定条件下,氢气与氮气混合发生反应,下列有关说法正确的是( )
①因为增大压强,反应速率加快,平衡正向移动,所以在生产中压强越大越好
②降低温度,平衡正向移动,但是反应速率减慢,所以温度要选500℃
③使用铁触媒可以大大加快反应速率
④将氨变成液体,及时从平衡混合气中分离出去,可以使平衡正向移动
⑤氮气、氢气要循环使用,增加氮气的量,可以提高氢气的转化率,但氮气的转化率会降低
⑥可以选用的催化剂很多,且催化剂可以提高平衡转化率
A.③④⑤ B.①③⑤ C.②④⑥ D.③④⑥
2.可逆反应∶2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2 ②单位时间内生成n molO2 的同时,生成2n mol NO ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B.②③⑤ C.①③④ D. ①②③④⑤⑥
1. 在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI H2+I2 (气) 。下列叙述中一定属于平衡状态的是( )
在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI H2+I2 (气) 。下列叙述中一定属于平衡状态的是( )
A. HI、H2、I2的浓度相等 B. 混合气体的颜色不变化时
C. 混合气体的总压不变时 D. v(HI):v(H2):v(I2)=2:1:1时
16.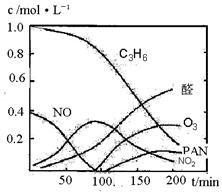 (10分)汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线。结合曲线,试回答下列问题。
(10分)汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线。结合曲线,试回答下列问题。
(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理
▲ 。
(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0-100min内,平均反应速率最大的是:
▲ (选填:C3H6、NO、NO2、醛、O3、PAN)
(3)已知: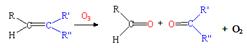 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平) ▲ 。
,写出丙烯与臭氧作用生成醛的化学方程式(并配平) ▲ 。
(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法。在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为: ▲ 。
(5)2000K时,可以发生如下反应:
1/2N2+1/2O2 NO, K1
NO, K1
1/2N2+O2 NO2, K2
NO2, K2
4NO 2NO2+N2,该反应的平衡常数K3= ▲ (用K1、K2表示)。
2NO2+N2,该反应的平衡常数K3= ▲ (用K1、K2表示)。
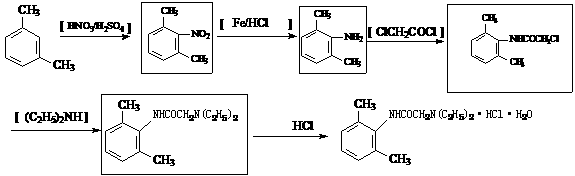
17(12分).雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:
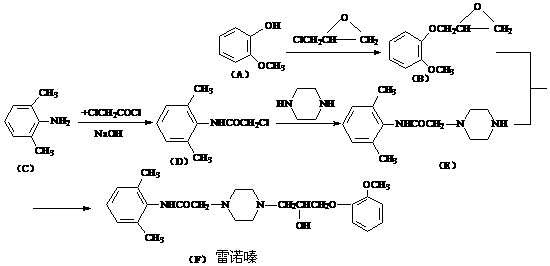
(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称: ▲ 、 ▲ 。
(2)写出满足下列条件A的同分异构体的数目 ▲ 。
①A能与FeCl3溶液发生显色反应;②1molA可与2molNaOH反应。
(3)C→D中,加入适量NaOH的作用是: ▲ 。
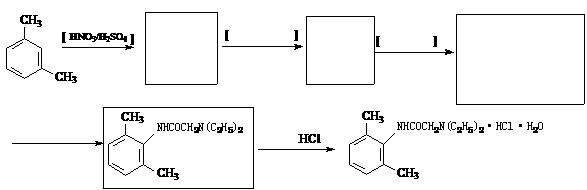
(4)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。
已知:
18(10分).据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油的替代品。研究发现,如果使用铁作催化剂,二氧化碳与氢气反应产生30%的甲烷,其余的短链烃可以被用来提炼燃料。
(1)为延缓全球温室效应,二氧化碳捕获和封存技术(CCS)是当今化学的前沿技术,下列通过化学反应捕获二氧化碳的反应,其原子利用率达100%的是 ▲ 。
(a)CO2 +CaO  CaCO3
CaCO3
(b)K2CO3+CO2+H2O=2KHCO3
(c)2Mg+CO2 2MgO+C
2MgO+C
(d)
(2)用二氧化碳合成烃,需要提供辅助原料氢气,下列制取氢气的方法可行且二氧化碳零排放的是 ▲ 。
(a)用太阳能光解海水制氢 (b)利用天然气与水高温催化制氢
(c)利用活泼金属与海水反应制氢 (d)利用核反应堆多余的电能电解海水制氢
(3)所谓FT合成,就是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
(4)某文献报道:在300℃、30MPa,以Fe、CoCl2作催化剂条件下,CO2和H2反应生成丁烷和戊烷。
①假定在一实验容器中充入一定量的CO2和H2,加入催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
②据问题①,今有标准状况下的CO2448L, n(丁烷)/n(戊烷) =x,消耗H2的物质的量为y,则y= ▲ (用x表示)。
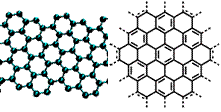 19(12分)A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
19(12分)A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
(1)下列有关石墨烯说法正确的是 ▲ 。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
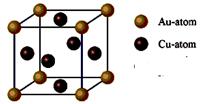 (2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为: ▲ 。
②乙醇沸点比氯乙烷高,主要原因是 ▲ 。
③右图是金与铜形成的金属互化物合金,它的化学式可表示为: ▲ 。
④含碳源中属于非极性分子的是 ▲ (a.甲烷 b.乙炔 c.苯 d.乙醇)
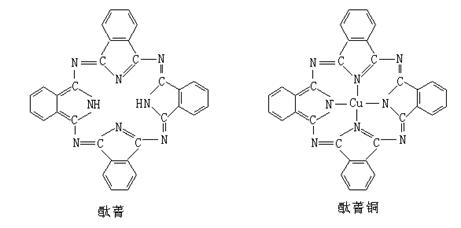
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:
▲ ;酞菁铜分子中心离子的配位数为: ▲ 。
19B.硫酸钾是重要的化工产品,生产方法很多,如曼海姆法、石膏两步转化法等。

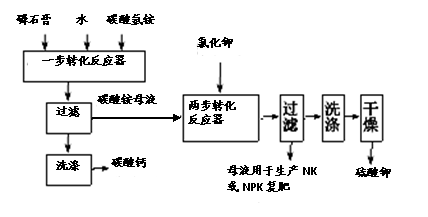
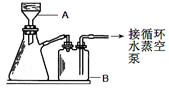
(1)本实验中,采用抽滤方法,图中A、B两仪器名称分别为: ▲ 、 ▲ 。
(2)在一部转化反应器中发生的反应为:CaSO4·2H2O+2NH4HCO3=(NH4)2SO4+CaCO3+CO2↑+3H2O,该步反应温度必须低于35℃,其主要目的是 ▲ 。
(3)在两步转化反应器中发生反应的化学方程式为 ▲ 。
(4)两步转化反应器中用乙二醇代替水作溶剂,其目的是 ▲ 。
(5)磷石膏主要成分为二水硫酸钙(CaSO4•2H2O) ,还含有未分解的磷矿, 未洗涤干净的磷酸、氟化钙、铁铝氧化物等,欲检验母液中含Fe3+,可用亚铁氰化钾溶液检验,该检验反应的离子方程式为: ▲ 。
(6)该法优点除K2SO4产率高外,再列举一个优点 ▲ 。
化学试题答案及评分标准
13(12分).
(1)H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度(2分).
(2)c(1分)(3)①酸(1分);②2,5,6=2,8, 5O2;(2分)③13.3%(2分);
④偏高(2分) ⑤尿素(写水杨酸稳定剂也得分)(2分)
14(12分).
(1)Ⅰ、Ⅲ(2分) (2)分馏(蒸馏)(2分)
(3)Ca3(PO4)2+5C+3SiO2 3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
(4)SiHCl3会水解,同时产生的H2,与O2混合发生爆炸等(2分)
(5)CH3OH+H2O-6e-=CO2+6H+(2分)
15(10分).
(1)①不能(2分);②-970.2(2分);③除去其中的过量的钠并溶解氯化钠及钛的低价氯化物(1分)
(2)①TiO2 +4e- = Ti +O2-(或:Ca2++2e-=Ca ,2Ca+TiO2 = 2CaO +Ti)(2分)
②H2(1分)(3)d(2分)
16(10分).
(1)b(2分) (2)NO(2分)
(3)CH3CH=CH2+2O3→CH3CHO+HCHO+2O2 (2分)
(4)4NH3+6NO  5N2+6H2O(2分)(5)K22/K14(2分)
5N2+6H2O(2分)(5)K22/K14(2分)
17(12分).(1)羟基、醚键(2分,) (2)6 (2分)
(3)与取代产物HCl作用,使平衡向生成D的方向移动,提高D的产率(2分)。
(4)
(每空1分,共6分)
18(10分).
(1)abd(2分,选对1个或2个得1分,多选错选不得分)
(2)ad(2分,选对1个得1分,多选错选不得分)
(3)8CO2 + 20H2 C8H18
+16H2O(2分)
C8H18
+16H2O(2分)
(4)①3.2<a<3.25 (2分) ②(260x+320)/(4x+5)(2分)
19(12分).
A.
(1)BD(2分,选对1个得1分,多选错选不得分)
(2)①[Ar]3d74s2 (2分) ②乙醇分子间可形成氢键,而氯乙烷分子间无氢键(1分);
③Cu3 Au或Au Cu3 (1分) ④a、b、c(2分)⑤sp3和sp2 (2分) ;2(2分)
B.
(1)布氏漏斗;安全瓶 (各1分,共2分)
(2)防止NH4HCO3分解(2分)
本卷中所有合理答案均酌情给分。
(3)(NH4)2SO4+2KCl=K2SO4+2NH4Cl(2分)
(4)降低K2SO4溶解度,有利于K2SO4析出,提高产率(2分)
(5)Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓(2分)
(6)原料得到充分利用,同时得到副产品化肥等(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com