
题目列表(包括答案和解析)
9.(2008海南高考,第12题)在pH=13的无色溶液中,可以大量共存的一组离子是( )
A、NH4+、NO3- 、K+、SO42-
B、CO32-、NO3-、HCO3-、Na+
C、Na+、ClO-、AlO2-、NO3-
D、CrO42-、K+、Na+、SO42-
8.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断不正确的是 ( )
A.该混盐与硫酸反应产生1molCl2时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中的氯元素的化合价为+1和-1
7.氯酸(HCIO3)是一种强氧化性酸,若将铜粉投入氯酸溶液中,不可能生成的是( )
A.氯酸铜 B.高氯酸铜 C.氯化铜 D.氢气
6.今有甲乙丙三瓶等体积的新制氯水,浓度均为0.1mol/L ,如果在甲瓶中加入少量的NaHCO3晶体, 在乙瓶中加入少量的NaHSO3晶体, 丙瓶不变, 片刻后甲乙丙三瓶溶液中HCIO的物质的量浓度大小关系是〈溶液体积变化忽略不计〉( )
A 、甲=乙﹥丙 B、 甲﹥丙﹥乙 C 、丙﹥甲=乙 D、 乙﹥丙﹥甲
5、氧化能力是以"有效氯"的含量来标志。"有效氯"的含量定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。请问纯LiClO的"有效氯"为 ( )
A.121% B.100% C.89% D.21%
4.下列各组物质中,每一种物质都能使溴水褪色的是( )
A.AgNO3溶液、CCl4、碘水
B.Na2SO3溶液、FeCl3溶液、H2S溶液
C.FeCl2溶液、KOH溶液、镁粉
D.NaOH溶液、CO气体、氯水
3、下列溶液能使红色花瓣快速褪色的是( )
A、稀盐酸 B、新制氯水
C、氯化钙稀溶液 D、生理盐水
2.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是( )
A.NaNO3 B.FeCl2 C.Na2SO4 D.AlCl3
1.向盐酸中加入浓硫酸时产生白雾,下列叙述不属于产生该现象的原因是( )
A.浓硫酸具有脱水性 B.浓硫酸具有吸水性
C.盐酸具有挥发性 D.气体的溶解度的随温度升高而降低
9.黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O = SO42 -+2Fe2++4H+
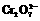 +6Fe2++14H+ = 2Cr3++6Fe3++7H2O
+6Fe2++14H+ = 2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________________。
(2)若燃烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式__________________。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_________L,制得98%的硫酸质量为________t,SO2全部转化为H2SO4时放出的热量是___________kJ。
2010年高考总复习化学培优补差训练(25)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com