
题目列表(包括答案和解析)
5.将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为 ( )
A. 9 B.10 C.11 D.12
4.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关
判断正确的是 ( )
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
3.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确
的是 ( )
A.加入适量的氯化铵晶体后,两溶液的pH均碱小36502119
B.温度下降10oC,两溶液的pH均不变 C.用盐酸中和,消耗的盐酸体积相同
D.分别加水稀释10倍,两溶液的pH仍相等
2.25 ℃时,pH=3的盐酸a L分别与下列3种溶液充分混合后,溶液均呈中性: ① c(NH3·H2O)=10-3 mol/的氨水b L;②c(OH-)=10-3 mol/L的氨水c L;③c(OH-)=10-3mol/L的Ba(OH)2溶液d L,试判断a、b、c、d的数量大小关系为 ( )
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
1.向10mL pH=12的某碱溶液中加入10mL pH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是 ( )
A.弱碱 B.一元强碱 C.多元强碱 D.任何碱
12.已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:
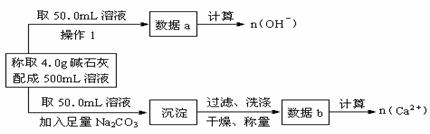
① 写出n (OH-)、n (Ca2+)与n (Na+)的关系:n(Na+)= 。
② 设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
|
碱石灰的可能组成 |
NaOH、CaO |
NaOH、CaO、 Ca (OH)2 |
NaOH、Ca (OH)2 |
NaOH、Ca (OH)2、H2O |
|
n (Na+)、n (Ca2+) 的关系 |
40x+56y
= 4 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g。请通过计算确定该碱石灰各成分的质量分数。
2010年高考总复习化学培优补差训练(21)
11. 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O= NH4HCO3 ; NH4HCO3+NaCl=NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
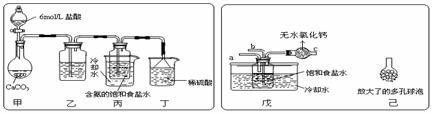
(2)某探究活动小组根据上述制碱原理进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入 气体,再从b管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
10.把一瓶不饱和的烧碱溶液分成4等份。保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是()
A.加入的NaOH质量一定最大 B.加入的Na2O2和Na2O的物质的量之比为1︰1
C.制成饱和溶液后,4份溶液中所含NaOH质量相同
D.加入的NaOH、Na2O2、Na2O、Na的物质的量之比为2∶1∶1∶2
9.  有化合物X、Y、Z、W,其焰色反应均为紫色。它们按下列反应式转化:
有化合物X、Y、Z、W,其焰色反应均为紫色。它们按下列反应式转化:
①X + Ca(OH)2 → Y + CaCO3↓ ②W X + CO2↑ + H2O
③Z + CO2 →X + O2↑ ④Z+ H2O → Y + O2↑,则X、Y、Z、W依次是:()
A、KCl、KOH、K2CO3、KHCO3 B、K2CO3、KOH、K2O2、KHCO3
C、K2SO3、KOH、K2O2、KHCO3 D、KHCO3 、KOH、K2O2、K2CO3
8. 向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)()
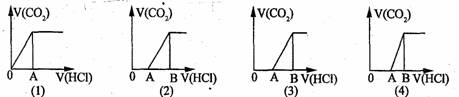
A.M中只有一种溶质的有(1)和(3) B.M中有两种溶质的有(2)和(4)
C.2)图显示M中c(NaHCO3)>c(Na2CO3) D.(4)图显示M中c(NaHCO3)>c(Na2CO3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com