
题目列表(包括答案和解析)
6.一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的物质的量之比{n(x)/n(y)}关系如图,则x和y反应的方程式可表示为 ( )
A.X + 3Y 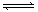 2Z 且a代表X的转化率,b代表Y的转化率
2Z 且a代表X的转化率,b代表Y的转化率
B.3X+ Y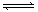 2Z 且a代表Y的转化率,b代表X的转化率
2Z 且a代表Y的转化率,b代表X的转化率
C.3X + 2Y 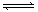 Z 且a代表Y的转化率,b代表X的转化率
Z 且a代表Y的转化率,b代表X的转化率
D.6X+ 2Y 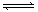 Z 且a代表X的转化率,b代表Y的转化率
Z 且a代表X的转化率,b代表Y的转化率
|
|
|
5.在相同温度和定容的条件下,有下列反应:
2A(气)+2B(气) C(气)+3D(气)。现分别从两条途径建立平衡:
C(气)+3D(气)。现分别从两条途径建立平衡:
I.A、B的起始物质的量均为2mol;
II.C、D的起始物质的量分别为2mol和6mol。
以下叙述中正确的是 ( )
A.I和II两途径最终达到平衡时,体系内混合气体的百分组成相同
B.I和II两途径最终达到平衡时,体系内混合气体的百分组成不同
C.达平衡时,I途径的反应速率等于II途径的反应速率
D.达平衡时,I途径所得混和气的密度与II途径所得混合气密度相等
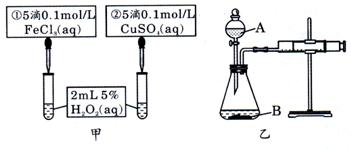
4.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ( )
①NaOH(固体) ; ②H2O; ③NH4Cl(固体)
④CH3COONa(固体); ⑤CuSO4溶液; ⑥Na2SO4溶液
A.①②③④ B.①②④⑥ C.③⑤ D.②④⑥
3.在密闭容器中存在下列平衡:CaCO3(s)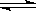 CaO(s)+CO2(g),CO2的平衡浓度为C1mol/L,现再充入CO2使其浓度达到2C1mol/L,重新达到平衡后,CO2的浓度为C2mol/L(设温度不变),则C1和C2的关系是
( )
CaO(s)+CO2(g),CO2的平衡浓度为C1mol/L,现再充入CO2使其浓度达到2C1mol/L,重新达到平衡后,CO2的浓度为C2mol/L(设温度不变),则C1和C2的关系是
( )
A. C1<C2 B. C1=C2 C. C1>C2 D. 2C1=C2
2.所有化学平衡都是一种动态平衡,下列说法中不正确的是 ( )
A.在合成氨的平衡体系中,一定存在N2、H2、NH3三种物质
B.BaSO4的沉淀溶解平衡中,不存在溶解的BaSO4分子
C.在醋酸溶液中,一定存在H+、OH-、CH3COO-、CH3COOH分子、H2O分子
D.往平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入KCl固体,平衡将向逆反应方向移动,溶液颜色将变浅
Fe(SCN)3+3KCl中加入KCl固体,平衡将向逆反应方向移动,溶液颜色将变浅
1.下列反应中,可能高温正向自发,低温逆向自发的是 ( )
A.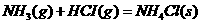
B.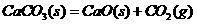
C.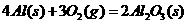
D.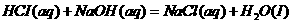
25.(17分)
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)Z2O 和黑色的ZO两种氧化物。
(1) W位于元素周期表第_____周期第____族。W的气态氢化物稳定性比H2O(g)____ _(填“强”或“弱”)。
(2) Y的基态原子核外电子排布式_______,Y的第一电离能比X的_____(填“大”或“小”)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________________________________________________________________________。
(4)已知下列数据:

X的单质和FeO反应的热化学方程式是____________________________。
[解析]
第25题考查元素周期律和周期表以及原子核外电子排布式、电离能等。
题中给出的信息比较明显,导致酸雨的氧化物主要是SO2和NO2,根据原子序数依次增大可以判断出W为N元素,Y为S,N在周期表中为第二周期第VA族,其气态氢化物NH3稳定性比H2O弱。
Y为S原子基态原子核外电子排布式为1s22s22p63s23p4,根据“X的基态原子核外有7个原子轨道填充了电子”,可以画出起核外电子轨道式: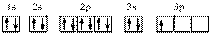 ,或结合题目第4小题第二个方程式生成X2O3,能确定X化合价为+3,N和S之间能形成+3价元素只有Al。
,或结合题目第4小题第二个方程式生成X2O3,能确定X化合价为+3,N和S之间能形成+3价元素只有Al。
题中“Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物”知Z为Cu。
第(3)题即为: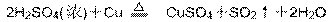 ‘
‘
第(4)题根据盖斯定律,将②-①×3可得答案:
2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s) △H=-859.7kJ/mol
26

(1) A 与银氨溶液反应有银镜生成,则A的结构简式是
(2) B→C的反应类型是
(3) E的结构简式是
(4) 写出F和过量NaOH溶液共热时反应的化学方程式
(5) 下列关于G的说法正确的是
A 能于溴单质反应 B 能与金属钠反应
C 1mol G最多能和3mol 氢气反应 D 分子式是C9H6O3
[解析]
第26题是一道非常简单的有机题,A到B(CH3COOH)的转化条件是“O2,催化剂”,后第(1)题有提示“A与银氨溶液反应有银镜生成”,故A为CH3CHO。
B到C的转化从反应物CH3COOH到生成物CH3COCl,可以看出这是取代反应。
D到E的转化条件是“CH3OH,浓硫酸”,这是典型的酯化反应的条件,故E为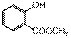 ,
,
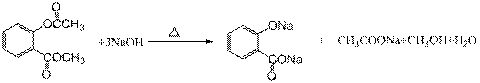
C和E在催化剂作用下反应生成F( ),F有两个酯基,且上面的酯基水解后生成酚羟基,故1mol F可以消耗3mol NaOH,故发生反应方程式为:
),F有两个酯基,且上面的酯基水解后生成酚羟基,故1mol F可以消耗3mol NaOH,故发生反应方程式为:
F到G的转化条件是“①Na2CO3,液体石蜡②HCl”,此条件中学中没有出现过,但并不影响答题,解决这一步并不需要知道这个条件是发生什么样的反应,考生没必要再此处花更多的时间,并且没有跟这步有关的问题。
G的结构 ,可以判断其官能团有酯基,羟基,碳碳双键,苯环。有碳碳双键可以和溴单质加成,有羟基可以跟金属钠反应,1mol G最多可以和4mol H2 加成,G的分子式为C9H6O3。
,可以判断其官能团有酯基,羟基,碳碳双键,苯环。有碳碳双键可以和溴单质加成,有羟基可以跟金属钠反应,1mol G最多可以和4mol H2 加成,G的分子式为C9H6O3。
27
某工厂废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验:
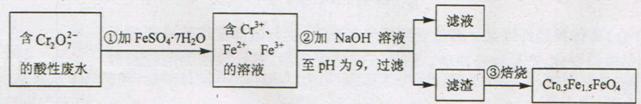
(1) 第①步反应的离子方程式是
(2) 第②步中用pH实纸测定溶液pH的操作是
(3) 第②步过滤的到的滤杂中只要成分除Cr(OH)3 ,理论上需要加入 g FeSO4·7H2O。
[解析]
第27题是一道类似于无机推断的信息框图题。
“含Cr2O72-的酸性废水”经过第①步加FeSO4·7H2O后得到“含Cr3+、Fe2+、Fe3+的溶液”,根据信息很容易就能写出该步反应的离子方程式:Cr2O72-+6Fe2++14H+=7H2O+2Cr3++6Fe3+。
使用pH试纸测定溶液pH值是中学生必须掌握的基本操作之一,这个问题很简单。
“第②步加NaOH溶液至pH为9,过滤”,因这一步之前得到的是“含Cr3+、Fe2+、Fe3+的溶液”,故滤渣的主要成分是Cr(OH)3、Fe(OH)3、Fe(OH)2。
第(4)题,根据组成Cr0.5Fe1.5FeO4,知Cr元素与Fe元素物质的量比为0.5:(1.5+1)=1:5,可列式计算5×10-3mol/L×1L×2×5×278g·mol-1=13.9g。
28
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2 ,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
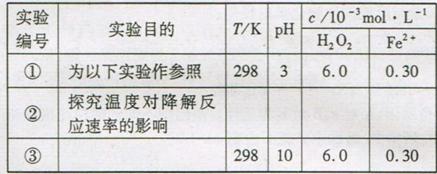

[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50-150s内的反应速率;
v(p-CP)= mol·L-1·s-1
[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2 的角度分析原因:
(4)实验③得出的结论是:pH=10时,
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中信息,给出一种迅速停止反应的方法:
[解析]
第28题是一道新型的实验探究题,根据题给信息能很容易解决这道题。
第(1)题:由题中“控制p-CP的初始浓度相同恒定在实验温度在298K或313K(其余实验条件见下表)”这句话中的信息能解决表格的第二列“探究温度对降解反应速率的影响”,故表格这一行应该填写“313,3,6.0,0.30”,第三行①③对比可以发现其他温度、浓度均没发生变化,就pH值由3变成10,所以第三行空中应该填写的是“探究溶液的pH值对降解反应速率的影响”。
第(2)题很简单,根据化学反应速率的定义,结合图像即可计算出结果,v(p-CP)=(1.2-0.8)×10-3/(150-50)=8×10-6 mol·L-1·s-1。
第(3)题提示“请从Fenton法所用试剂H2O2 的角度解释”,通过平时的学习知,H2O2 温度高时不稳定,故虽然高温能加快化学反应速率,但温度过高就是导致H2O2 分解,没了反应物,速率自然会减小。
第(4)小题,可由图像观察得到,图像中随时间变化曲线③表示在pH=10时,浓度不变,说明化学反应速率为0,化学反应停止。
第(5)题,可以根据第四小题回答,使反应迅速停止,可以向溶液加碱,调节pH=10即可。
13.向体积Va的0.05mol·L-1 CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A、Va>Vb时:c(CH3COOH )+c(CH3COO-)>c(K+)
B、Va=Vb时:c(CH3COOH)+ c(H+)=c(OH-)
C、Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D、Va与Vb任意比时:c(K+)+ c(H+)= c(OH-)+ c(CH3COO-)
[解析]
第13题考查的是电解质溶液中各种守恒关系和离子浓度比较,题型比较保守,此题的解题方法是先让CH3COOH和KOH反应,然后找到反应后的溶质,即:
A项:Va>Vb,反应后溶质为CH3COOH和CH3COOK的混合物,A正确。
B项:Va=Vb,反应后溶质为CH3COOK,根据质子守恒,可得B正确。
C项:Va<Vb,反应后溶质为CH3COOK和KOH混合物,可知c(K+)>c(CH3COO-),C错。
D项:为电荷守恒,D正确。
12、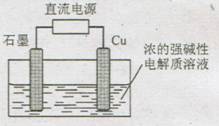 Cu2O 是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O
Cu2O 是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
A、石墨电极上产生氢气
B、铜电极发生还原反应
C、铜电极直接流电源的负极
D、当有0.1mol电子转移时,有0.1moI Cu2O生成
[解析]
第12题主要考查的是电化学中电解池的知识,题目比较新颖,但是比较简单,学生可以通过给出的化学方程式2Cu+H2O
 Cu2O+H2↑,通过氧化还原反应规律,Cu失电子,为阳极,与铜相连的为电源正极,石墨为阴极,与石墨相连的为电源负极。
Cu2O+H2↑,通过氧化还原反应规律,Cu失电子,为阳极,与铜相连的为电源正极,石墨为阴极,与石墨相连的为电源负极。
Cu电极为阳极,电极反应式:2Cu-2e-+2OH- Cu2O+H2O,失电子,发生氧化反应;当有2mol电子通过时,生成1mol Cu2O,当有0.1mol电子通过时,生成0.05mol Cu2O。
Cu2O+H2O,失电子,发生氧化反应;当有2mol电子通过时,生成1mol Cu2O,当有0.1mol电子通过时,生成0.05mol Cu2O。
石墨电极为阴极,电极反应式反应式为:2H2O+2e- 2OH-+H2↑,
2OH-+H2↑,
对照选项,可知选A。
11、汽车尾气净化中的一个反应如下:
NO(g)+CO(g) 1/2N2(g)+CO2(g) ⊿H=-373.4kJ/mol
1/2N2(g)+CO2(g) ⊿H=-373.4kJ/mol
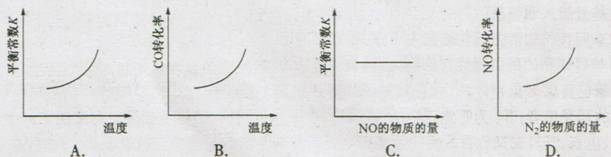
在恒容得密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
[解析]
第11题是一道化学平衡题,题中涉及到新教材中新引人的化学平衡常数、转化率等概念,本题考查内容较多,分别为化学平衡常数的概念及影响因素,外界条件对化学平衡的影响。由题给信息知,该反应为放热反应。
A项:根据平衡移动原理,温度升高,平衡逆向移动,化学平衡常数减小,A错。
B项:根据平衡移动原理,温度升高,平衡逆向移动,CO转化率减小,B错
C项:化学平衡常数只和温度有关,与其他条件无关。C正确
D项:根据平衡移动原理,增大N2 的物质的量,平衡逆向移动,NO转化率降低,D错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com