
题目列表(包括答案和解析)
14.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
13.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是
A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的分子式为HgNO3
D.硝酸亚汞的分子式为Hg2(NO3)2
12.下列各装置中都盛有0.1 mol·Lˉ1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是 ( )
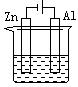
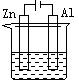
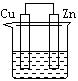
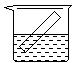
① ② ③ ④
A.③①④② B.①②④③ C.①②③④ D.②①④③
11.用惰性电极电解下列溶液一段时间后,再加入一定量的另一种物质(括号内),溶液能恢复到与原溶液完全一样的是 ( )
A.CuCl2 (CuSO4) B.NaOH (NaOH)
C.NaCl (HCl) D.CuSO4(Cu(OH)2)
10.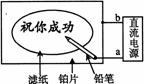 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
( )
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
( )
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
9.在1LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的物质的量浓度为 ( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 0.5 mol·L-1
8.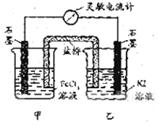
 控制适合的条件,将反应
控制适合的条件,将反应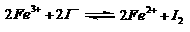 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
7. Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,电解总反应:2Cu+H2O==Cu2O+H2
Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,电解总反应:2Cu+H2O==Cu2O+H2 。下列说法正确的是
。下列说法正确的是
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
6.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是 ( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3eˉ=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:
Al-3eˉ+4OHˉ=AlO2ˉ+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2eˉ=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2eˉ=Cu2+
5.100 mL浓度为2 mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的醋酸钠溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com