
题目列表(包括答案和解析)
4.(15分)
利用芳香烃 X 和不饱和链烃 Y 可以合成紫外线吸收剂BAD,己知 G 的分子式为 C3H6O , G 不能发生银镜反应,1mol C与1 mol CO2在125 ℃ 4 00一 700kPa 的条件下完全反应生成1 mol D,BAD的合成路线如下:
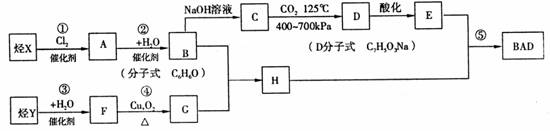
BAD 结构简式为:
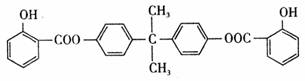
试回答下列问题:
( l )写出结构简式:
X_________________,D___________________。
( 2 )在反应 ①②③④⑤ 中属于取代反应的有______________________。
( 3 ) l mol BAD 最多可与含___________mol NaOH 的溶液完全反应。
( 4 )写出下列化学方程式:
反应 ④ ______________________________________________________,
B + G H __________________________________________________,
H __________________________________________________,
H + E BAD__________________________________________________。
BAD__________________________________________________。
3.(15分)A、B、C、D四种均为短周期元素,原子序数依次增大
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, Z在加热条件下跟水反应的产物1 mol需用3mol KOH才能完全中和。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)写出化学式: Y:_____________; Z:______________。
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用化学符号表示): _______________________________________________
(3)M可以使溴水褪色,写出该反应的离子方程式 ;
(4)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的离子方程式为
(5)常温下,D的氢化物呈气态,有毒,水溶液呈酸性。脱除天然气中D的氢化物既能减少环境污染,又可回收D的单质。用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单质,其电解总反应方程式(忽略溶解氧的氧化还原反应)为
__________ ;
该方法的优点是______ 。
2.(16分)实验室制取氨与氨的有关性质实验会用到如下甲、乙、丙、丁四套装置:
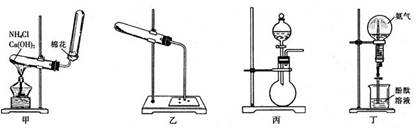
(1)实验室通常利用图甲所示的装置来制取氨。简述点燃酒精灯后给试管加热的操作过程__________________________________________,说明发生装置试管口略向下倾斜的原因_____________________________ w.w.^w.k.&s.5*
___;
(2)图乙点滴板(或玻璃片)的3个凹穴中分别滴入1滴浓盐酸、浓硝酸和浓硫酸。然后加热NH4Cl和Ca(OH)2的混合物,当有氨放出时,移动点滴板,使导管口对准不同的酸。简述观察到的主要现象___________________________________________;
(3)实验室利用图丙所示的装置也可制取氨,指出所用的药品为__________________,利用相关化学原理解释产生氨的理由__________________________________________
(4)某学生欲用图丁装置进行喷泉实验,结果失败,试分析失败的可能原因(填至少3个要点)___________________________________________________ _____;
(5)若某学生用图丁装置成功进行了喷泉实验,已知烧瓶中用排空气法收集到的氨气(标准状况下)相对H2的密度为9,则理论上得到氨水的物质的量浓度约为_______mol/L.
1.(15分已知甲、乙、丙、丁、戊五种微粒为短周期元素形成的粒子,它们的电子总数都为18,请回答下列问题:
(1)甲为双核分子,可与水发生置换反应,写出其化学方程式__________________________;
(2)乙为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,写出该反应的离子方程式________________________________;
(3)丙为含两种元素的分子,且原子个数比为1:1,其水溶液呈弱酸性,写出其主要的电离方程式________________________________;
(4)丁为六原子分子,人误饮少量丁能使人眼睛失明,写出丁的电子式______________;
(5)戊属于烃,已知1g戊在空气中完全燃烧放出52kJ的热量,写出戊的燃烧的热化学方程式_________________________________________。w.w.^w.k.&s.5*
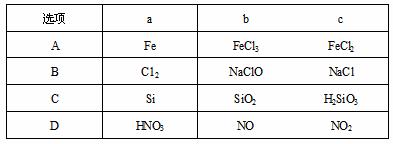
23.下列各组物质中,不能按 (“→’’表示一步完成)的关系相互转化的是
(“→’’表示一步完成)的关系相互转化的是
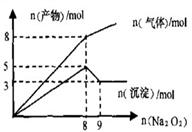
22.将Na2O2逐渐加入到含有A1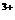 、Mg
、Mg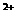 、NH
、NH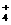 的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al
的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al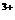 、Mg
、Mg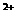 、NH
、NH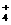 的物质的量分别是
的物质的量分别是
A.2 mol、3 mol、8 mol B.3 mol、2 mol、8 mol
C.Z mol、3 mol、4 mol D.3 mol、2 mol、4 mol
21.下列除去杂质的方法正确的是
A.除去氯化钠溶液中的氯化钙:通足量的二氧化碳气体后再过滤
 B.除去乙酸乙酯中的乙酸:加入足量的氢氧化钠溶液
B.除去乙酸乙酯中的乙酸:加入足量的氢氧化钠溶液
C.除去FeCl3酸性溶液中的少量的FeCl2:通人足量的C12
D.除去苯中的苯酚:加入足量的浓溴水后再过滤
20.阿伏加德罗常数为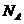 ,下列叙述中正确的是
,下列叙述中正确的是
A.1 mol FeCl3 完全转化成Fe(OH)3胶体,便有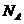 一个Fe(OH)3胶粒
一个Fe(OH)3胶粒
B.在1 mol的CH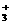 (碳正离子)中,所含的电子数为l0
(碳正离子)中,所含的电子数为l0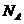
C.31 g白磷分子(P4)中含有P-P键数目为1.5 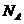
D.2 mol/L 50 mL Na2CO3溶液中CO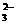 离子数为0.1
离子数为0.1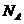
19.有A、B、C、D、E五种金属,A的溴化物在常温下见光分解生成黑色的A;B的氧化物在空气中加热到熔融时不分解;B和C用导线项链。在稀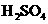 中组成原电池时,C上有气体产生;D放入C的硫酸盐溶液中得到C的稳定氢氧化物沉淀;用E作电极电解C的盐酸盐溶液时,阴极上放出氢气,阳极上放出氯气,则关与五种金属活动顺序的叙述正确的是
中组成原电池时,C上有气体产生;D放入C的硫酸盐溶液中得到C的稳定氢氧化物沉淀;用E作电极电解C的盐酸盐溶液时,阴极上放出氢气,阳极上放出氯气,则关与五种金属活动顺序的叙述正确的是
A.只能判断出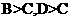 B.可判断出
B.可判断出
C.可判断出 D.可判断出
D.可判断出
18.已知反应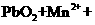 (1)
(1)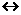
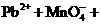 (2)(反应式未配平),下列说法正确的是w.w.^w.k.&s.5*
(2)(反应式未配平),下列说法正确的是w.w.^w.k.&s.5*
A.(1)为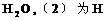
B.氧化产物与还原产物的物质的量比为5:2
C.每生成2 mol的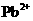 ,转移的电子数为 10 mol
,转移的电子数为 10 mol
D.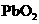 的氧化性强于酸性环境下的
的氧化性强于酸性环境下的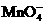
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com