
题目列表(包括答案和解析)
8.下列说法错误的是
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
7.下列反应离子方程式正确的是 ( )
A.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4 Fe3++2H2O
C.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O
D. H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42- BaSO4↓+H2O
6.2010年上海世博会将实现环保世博、生态世博目标,下列做法中不符合这一目标的是
A.部分国家的展馆使用可降解的建筑材料
B.把世博会期间产生的垃圾焚烧或深埋处理
C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
D.停车场安装了催化光解设施,用于处理汽车尾气
31. [有机化学基础]
[有机化学基础]
已知:
(1)该反应的生成物中含有的官能团的名称为 ,该类物质在一定条件下能发生
(填序号)。
①银镜反应 ②酯化反应 ③还原反应 ④消去反应 ⑤加成反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子都在同一平面内,R1可以为 (填序号);
①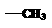 ②
②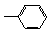 ③
③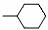
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:
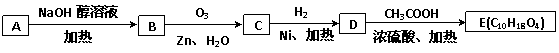
结构分析表明E分子中含两个甲基且没有支链。试回答:
①写出C的分子式 ;写出A的结构简式 。
②写出由D生成E的的化学方程式 。
30.[物质结构与性质]
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C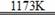 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C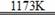 TiCl4+2CO
TiCl4+2CO
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg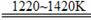 Ti+2MgCl2
Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为 。
(2)与CO互为等电子体的离子为 (填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp1杂化的分子有 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于 (填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是
 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其
中金红石的晶胞如右图所示,则其中Ti4+的配位数为 。
25.(15分)
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g),混合体系
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g),混合体系
中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
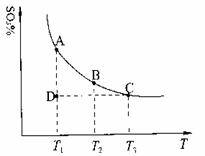
 ①2SO2(g)+O2(g)
2SO3(g)的△H 0
①2SO2(g)+O2(g)
2SO3(g)的△H 0
(填“>”或“<”);若在恒温、恒压条件下向上述平衡体
系中通入氦气,平衡 移动(填“向左”、“向右”
或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则:
K1 K2;若反应进行到状态D时,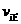
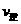 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3
过程中能量变化示意图,请写出工业合成氨的热化学反应
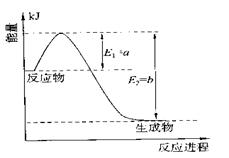 方程式:
。
方程式:
。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与
b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是
,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时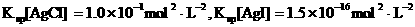 )
)
[选考部分]
24.(15分)
(16分)用含少量铁的氧化物的氧化铜制取氯化铜晶体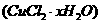 。有如下操作:
。有如下操作:
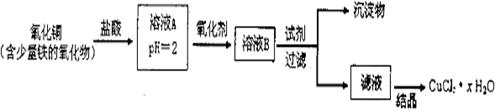
已知:在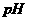 为4-5时,
为4-5时,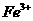 几乎完全水解而沉淀,而此时
几乎完全水解而沉淀,而此时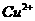 却几乎不水解。
却几乎不水解。
(1)溶液 中的金属离子有
中的金属离子有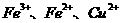 。检验溶液
。检验溶液 中
中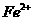 的最佳试剂为
(填编号,下同)
的最佳试剂为
(填编号,下同)
①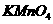 ②
②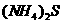 ③
③ ④
④
(2)氧化剂可选用 (多选)
①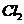 ②
②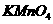 ③
③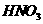 ④
④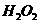
(3)要得到较纯的产品,试剂可选用 (多选)
① ②
②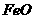 ③
③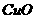 ④
④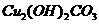
(4)从滤液经过结晶得到氯化铜晶体的方法是 (按实验先后顺序选填编号)
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液 中的
中的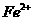 的浓度,实验前,首先要配制一定物质的量浓度的
的浓度,实验前,首先要配制一定物质的量浓度的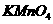 溶液
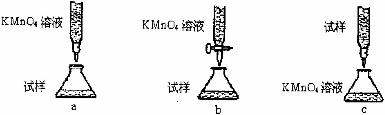
溶液 ,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需
,下列滴定方式中,最合理的是
,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需
,下列滴定方式中,最合理的是
(夹持部分略去)(填字母序号)
(6)为了测定制得氯化铜晶体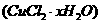 中
中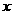 的值,某兴趣小组设计了两种实验方案:
的值,某兴趣小组设计了两种实验方案:
方案一:称取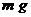 晶体灼烧至质量不再减轻为止,冷却、称量所得无水
晶体灼烧至质量不再减轻为止,冷却、称量所得无水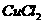 的质量为
的质量为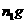 g。
g。
方案二:称取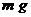 晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为
晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为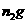 。
。
试评价上述两种实验方案:其中正确的方案是 ,据此计算得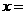 (用含
(用含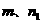 或
或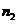 的代数式表示)。
的代数式表示)。
23.(15分)
A、B、C、D、E是含有同一元素的常见物质。C物质只由一种元素组成,在1个C分子中形成共价键的电子数与分子中所含电子数之比为3∶7。C、E均可与氧气在一定条件下反应生成A。请回答以下问题:
(1)常温下将气体B通入水中发生反应,生成A和D,则D的化学式为 。
(2)E的空间构型是 ;
写出E与氧气反应生成A化学方程式 。
(3)D与E反应的生成物在固体时的晶体类型是 ;
其水溶液中离子浓度由大到小的顺序是 。
(4)写出工业上合成E反应的化学方程式 ;
若使平衡向生成E的方向移动,可采取的措施有 (填写字母)。
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离E
(5)在标准状况下,2.24LE气体在氧气中完全燃烧生成气体单质C和液态水,放出热量QkJ,则该反应的热化学方程式为 。
12.已知常温下:KSP (AgCl) = 1.8×10-10 mol2·L-2,KSP (Ag2CrO4) = 1.9×10-12 mol3·L-3 , 下列叙述正确的是
A.AgCl在饱和NaCl溶液中的 KSP 比在纯水中的 KSP 小
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明 :KSP (AgCl) < KSP (AgI)
C.将0.001 mol·L- 1 的AgNO3 溶液滴入0.001 mol·L- 1 的KCl和0.001 mol·L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
第Ⅱ卷 (共58分)
[必考部分]
11.在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:
 A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n mol C。下列说法中正确的是( )
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n mol C。下列说法中正确的是( )
A.物质A、B的转化率之比为l:2
B.起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b-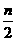 )
)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com