
题目列表(包括答案和解析)
8. 答案解析:(易)考查对物质的量、阿伏加德罗常数相关知识的理解,答案:C。物质的摩尔质量单位是“g·mol-1”,物质的质量单位是“g”,A不正确;B中转移电子数应为2NA;500mL 0.5mol·L-1Al2(SO4)3溶液中,SO42-的物质的量为3×0.5mol·L-1×0.5L=0.75mol,含SO42-数目为0.75NA,C正确。0.5NA个氧气分子为0.5mol ,在标准状况下所占的体积为0.5mol×22.4 L·mol-1 =11.2L,但常温常压下要比11.2L 略大,D不正确。
8.设NA为阿伏加德罗常数,下列说法中正确的是( )
A.Cl2的摩尔质量与NA个Cl2分子的质量在数值和单位上都相等。
B.活泼金属从盐酸中置换出1molH2,转移电子数为NA
C.500mL0.5mol·L-1Al2(SO4)3溶液中,含SO42-数目为0.75NA
D.常温常压下,0.5 NA个一氧化碳分子所占体积是11.2L
7. 答案解析:(中难)考查元素周期表(长式)的结构(周期、族)及其应用,答案:C。L层电子数为奇数的有锂、硼、氮、氟4种元素,锂是金属,硼、氮、氟是非金属。第三、四、五、六周期元素的数目分别是8、18、18、32。由左至右第8、9、10三列为Ⅷ族,是过渡元素,都是金属。最外层电子数为2的除第ⅡA族外,还有零族的He以及某些过渡元素。
7.根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
A.L电子层为奇数的所有元素都是非金属
B.第三、四、五、六周期元素的数目分别是8、18、32、32
C.由左至右第8、9、10三列元素中没有非金属元素
D.只有第ⅡA族元素的原子最外层有2个电子
6. 答案解析:(易)考查物质的分类知识,答案:D。明矾[KAl(SO4) 2·12H2O]、胆矾(CuSO4·5H2O)、石膏(CaSO4·2H2O)等结晶水水合物有一定的组成,是纯净物。玻璃是多种硅酸盐的混合物;冰是水的固态,是纯净物;蔗糖有固定的组成(C12H22O11),是纯净物;天然橡胶是高分子化合物,一般来说,高分子化合物都不是纯净物,天然物质通常含有多种物质。王水是硝酸和盐酸的混合物。弱酸H2SiO3、H2CO3是弱电解质;NaHCO3是强电解质;SO2、CO2、CH3CH2OH、NH3非电解质;Cl2是单质,既不是电解质也不是非电解质。
6.下列表中对于相关物质的分类全部正确的一组是
|
编号 |
纯净物 |
混合物 |
弱电解质 |
非电解质 |
|
A |
明矾 |
蔗糖 |
NaHCO3 |
CO2 |
|
B |
天然橡胶 |
石膏 |
SO2 |
CH3CH2OH |
|
C |
冰 |
王水 |
H2SiO3 |
Cl2 |
|
D |
胆矾 |
玻璃 |
H2CO3 |
NH3 |
27.答案解析:(难)在高温下,铁可与水蒸气发生反应,产物有Fe3O4和H2,产物Fe3O4可以与稀硫酸发生反应:Fe3O4+ 8H+══Fe2+ + 2Fe3+ + 4H2O。如果铁粉过量,还可发生:Fe+2Fe3+══3Fe2+,所以滤液中可能含有Fe3+,也可能不含Fe3+。检验溶液中含有Fe3+方法很多,最灵敏的方法是滴入几滴KSCN溶液,观察溶液颜色是否变红。Fe(OH)2不稳定,接触空气时很快被氧化成Fe(OH)3,要较长时间观察到白色沉淀的生成,关键是怎样降低反应体系中氧气的量,本题设计的装置能够成功地使Fe(OH)2长时间保持白色,关键在于用H2赶走了体系中的氧气。
27.(15分)常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是: 。
(2)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法: 。
(3)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合化学方程式说明) : 。
(4)某同学利用上述滤液制取白色的Fe(OH)2、沉淀,向滤液中加入NaOH溶液后,观察至生成的白色的沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→红褐色的化学方程式是: 。
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,有人设计如下图所示装置:
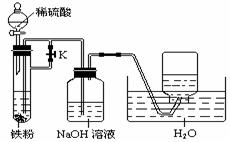
请简述实验操作及原理: 。
26.答案解析:(中难)该题是以NaNO2的性质为主题对氧化还原反应和离子反应的综合考查,要求学生能根据题目所给信息和要求,结合生活常识及有关物质发生氧化还原反应规律、配平规则,离子方程式书写技巧寻找结论,并规范作答。题中反应须在酸性条件下进行,生活中食醋显酸性。NaNO2→N2是一个还原过程,需加入还原剂才能实现。参考答案归纳如下:
(1)x:2(2分) y:4 (2分)
(2)食醋 (3分)(或醋,答醋酸不得分)
(3)c (2分) NH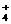 +NO
+NO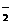 ══N2↑+2H2O (3分)
══N2↑+2H2O (3分)
技能空间: 第(1)小题可根据原子(碘原子)守恒来确定x的数值,由于I2的系数是1,所以前面的系数x=2,当然也可根据得失电子守恒来确定x的数值。然后根据氧原子守恒得z=2,再根据氢原子守恒得y=4,当然也可根据电荷守恒来确定y的数值。离子氧化还原反应方程式,除了要符合质量守恒、电子得失守恒,还要符合电荷守恒,即离子反应方程式等号左右两边离子所带电荷总数相等。
26.(12分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g-0.5g。已知NaNO2能发生如下反应(方程式已配平):
2NO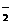 +xI-+yH+══2NO↑+I2+zH2O,请回答下列问题:
+xI-+yH+══2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x的数值是 ,y的数值是 。
(2)根据上述反应,可用化学试纸的生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为 。
(3)某工厂废切削液中含有2%-5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com