
题目列表(包括答案和解析)
3、(2006广东卷20)氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
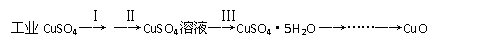 (1)制备氧化铜:
(1)制备氧化铜:
①步骤Ⅰ的目的是除不溶性杂质,操作是: 。
②步骤Ⅱ的目的是除铁,操作是:滴加H2O2溶液,稍加热;当Fe2+完全转化后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制pH =3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH =1。控制溶液pH =3.5的原因是: 。
③步骤Ⅲ的目的是得到CuSO4·5H2O固体,操作是: 、过滤、水浴加热烘干。水浴加热的特点是: 。
(2)探究氧化铜的性质:
①取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是: 。
②为探究试管A中的反应速率,收集气体并测定其体积必需的实验仪器有:
。
2、(1)2Cl--2e-=Cl2↑ 升高 (2)Ca2++CO32-= CaCO3↓, Mg2++2OH-=Mg(OH)2↓
 (3)a、c (4)b、c (5)蒸发;过滤
(3)a、c (4)b、c (5)蒸发;过滤
(6)2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑ Cl2+2NaOH=2NaClO+H2↑
2、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
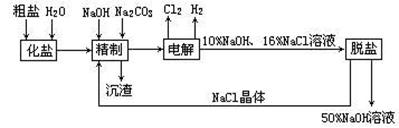
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ;与电源负极相连的电极附近,溶液PH (选填:不变、升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为:
。
(3)如果精盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 (选填:a、b、c);
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为 (选填:a、b、c);
a.先加NaOH,后加NaCO3,再加钡试剂 b.先加NaOH,后加钡试剂,再加Na2CO3 c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却 、(填操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
1、(1)MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑
MgCl2·6H2O MgO+2HCl↑+5H2O↑
MgO+2HCl↑+5H2O↑
 或Mg(OH)Cl
或Mg(OH)Cl MgO+HCl↑;MgCl2
Mg + Cl2 ↑
MgO+HCl↑;MgCl2
Mg + Cl2 ↑
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水水洗涤。
(3)搅拌,加速溶解 ;使待滤液体沿玻璃棒流入漏斗,防止外洒;
搅拌,防止因局部过热液滴或晶体飞溅。
1、海水的综合利用可以制备金属镁,其流程如下图所示:
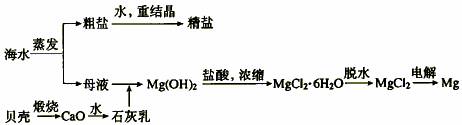
(1)若在空气中加热MgCl2·6H2O生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式 ;用电解法制取金属镁时,需要无水氯化镁。写出用电解法制取金属镁的化学方程式 。
(2)Mg(OH)2沉淀中混有Ca(OH)2应怎样除去?写出实验步骤。
________________________________________________________________________
。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:
溶解时:_________________________________________________________;
过滤时:_________________________________________________________;
蒸发时:_________________________________________________________。
2、从溶液中得到晶体:蒸发浓缩-冷却结晶-过滤-(洗涤)。
注意:
①在写某一步骤是为了除杂是,应该注明“是为了除去XX杂质”,只写“除杂”等一类万金油式的回答是不给分的。
②看清楚是写化学反应方程式还是离子方程式,注意配平。
2009-2010学年高考新题型工艺流程题
1、洗涤沉淀:往漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2-3次。
3、对综合生产效益有何影响?如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护(从绿色化学方面作答)。
常见文字叙述套路:
1、对反应速率有何影响? 2、对平衡转化率有何影响?
11.(24分)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
 ⑴ 用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
⑴ 用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 玻璃棒 (b) 烧杯 (c) 烧瓶
⑵步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是 和确定氧化Fe2+所需NaClO3的量
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全
(c) 确定下一步还原所需铁的量
⑶完成步骤IV中的氧化还原反应:补充产物并配平
__ Fe2++__ClO3-+__H+= __Fe3++_Cl-+__
⑷聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和 的质量(填写化合物的化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com