
题目列表(包括答案和解析)
8、(2008江苏17)工业上制备BaCl2的工艺流程图如下:
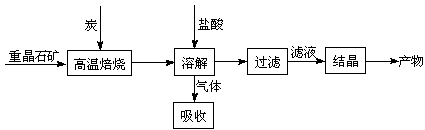
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)
△H1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为:
。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,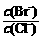 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
7、(1)①SiHCl3+H2 Si+3HCl
②3SiHCl3+3H2O=H2SiO3+H2↑+3HCl; 高温下,H2遇O2发生爆炸。
(2)ABCD
(3)生成白色絮状沉淀,有刺激性气味的气体生成;SiO32-与NH4+发生双水解反应,
SiO32- + 2 NH4+ + 2H2O = 2NH3·H2O + H2SiO3↓
7、(2008广东23)硅单质及其化合物应用范围很广。请回答下列问题:
 (1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 。
(2)下列有关硅材料的说法正确的是 (填字母)。
A、碳化硅化学性质稳定,可用于生产耐高温水泥
B、氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C、高纯度二氧化硅可用于制造高性能通讯材料-光导纤维
D、普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E、盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释
 。
。
6、(1)滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3。
(2)使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
(3)用已预热的布氏漏斗趁热抽滤。
(4)溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+,Na+,Cl-,SO42-,OH-,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
(5)Na2CO3·H2O(S)= Na2CO3(s) + H2O(g) ΔH= +58.73kJ/mol
6、 (2008广东19)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:
(2008广东19)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:
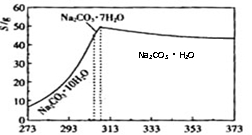
已知碳酸钠的溶解度(S)随温度变化的
曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为
。
(2)“趁热过滤”的原因是
。
(3)若在实验室进行“趁热过滤”,可采取的措施是
(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是
。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
5、(1)11.7 (2)蒸发皿 (3)35 ℃(33 ℃-40 ℃均可得分)。(4)加热法; 取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净。(5)重结晶。
5、(2007广东卷21)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
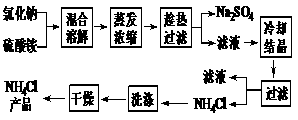

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7g NH4Cl,理论上需NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是
。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
4、(1)2MgCl2+(2-n)Ca(OH)2+2mH2O=2Mg(OH)2-n·Cln·mH2O+(2-n)CaCl2 (2)除去附着在Mg(OH)2表面的含等杂质MgCl2 的滤液。 (3)“水热处理”、“表面处理”。 (4)①分解时吸收大量的热量。
②Mg(OH)2,等质量的Mg(OH)2分解时吸收的热量比Al(OH)3大 (5)C;A会破坏臭氧层,B中的P元素会造成藻类生物的大量繁殖。
4、 (2006广东卷22)往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其使用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低,该Mg(OH)2的生产工艺如下:
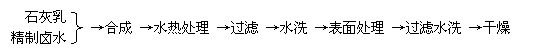
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-nCln·mH2O],反应的化学方程式为 。
(2)合成反应后,继续在393K-523K下水热处理8h,发生发应: Mg(OH)2-nCln·mH2O=(1-n/2)Mg(OH)2+n/2MgCl2+mH2O 水热处理后,过滤、水洗。水洗的目的是 。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。 (4)已知热化学方程式:Mg(OH)2(s)=MgO(s)+H2O(g);ΔH1=+81.5kJ/mol Al(OH)3(s)=1/2Al2O3(s)+3/2H2O(g);ΔH2=+87.7kJ/mol ①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。 ②等质量Mg(OH)2和Al(OH)3相比,阻燃效果最好的是 ,
原因是 。 (5)常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是______(填代号),理由是 。
3、(1)①称量、溶解、过滤 ②促进Fe3+转化Fe (OH)3沉淀,以防止Cu2+的水解。
③蒸发浓缩,冷却结晶, 可以控制加热温度,且温度不超过100℃,加热均匀。
(2)①CuO 对H2O2的分解有催化作用。 ②量筒、水槽、秒表、导管。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com