
题目列表(包括答案和解析)
13、(2009年广州调研测试题)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(粗盐中杂质离子为:SO42- 、Mg2+ 、Ca2+)

(1)精制过程中反应的离子方程式为____________________________________________
_________________________________________________________。
(2)电解过程的总反应方程式为_________________________________________。
(3)电解槽阳极产物可用于________________________________(至少写出两种用途)。
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
|
温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
|
NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐的主要工序应为_______________、_______________。脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是________
________________________________________________________________________________。
12、(1)搅拌、加热; (2)坩埚钳,用玻璃棒不断搅拌滤液; (3)NaCl;
(4)稀释溶液,防止降温过程中NaCl析出,提高产品的纯度; (5)重结晶
12、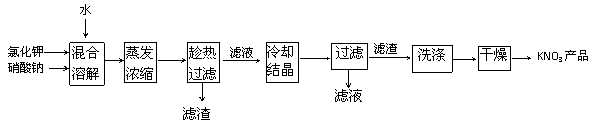 (2008年广州调研测试题)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
(2008年广州调研测试题)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:


硝酸钾等四种物质的溶解度随温度变化如右图所示。
回答下列问题:
(1)为了加速固体溶解,可采取的措施是:
。
(2)实验室进行蒸发浓缩操作时,将蒸发皿置于
铁圈上,用酒精灯加热。取用蒸发皿应使用 (填仪器的名称),为了防止液滴飞溅,进行的操作是 。
(3)“趁热过滤”操作中,滤渣的主要成分是(填化学式) 。
(4)“趁热过滤”后,有时先往滤液中加入少量水,加热至沸,然后再“冷却结晶”,目的是 。
(5)制得的KNO3产品中常含NaCl,进一步提纯的方法是

解析:该题可以说得上是流程题中的经典题目,它很好的考察了物质的分离与提纯中的一些基本操作,也考察了不同性质的物质在分离提纯时所采取的不同方法,特别是考察了温度这一外界因素在制备产品时所起的关键作用,通过前面的分析,我们很快可以得出正确的答案:
11、(1)乙 ;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。
(2)CuO + 2 H+= Cu2+ + H2O Fe + Cu2+ = Fe2+ + Cu (3)确保Cu完全置换出来
(4)可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);
将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥。
(5)蒸发浓缩 、过滤
11、(08广东六校第三次模拟)某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
方案甲:

方案乙:


(1)两个方案哪个符合当前生产的绿色理念,为什么?
。
(2)写出方案甲中的②③步骤反应的离子方程式:
、 。
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: 。
(4)用简便方法检验红色粉末中是否含有过量的铁屑
,如果有,请你提出合理的处理方案 。
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、
、洗涤、自然干燥得到一种俗称“绿矾”的工业产品
10、(1)Zn+2H+ Zn2++H2↑ Cd+2H+ Cd2++H2↑
(2)锌,
电解回收金属Zn (或者加入适量的生石灰,过滤;或者加入适量的氢氧化钡,过滤)
(3)阴极
Cd2+ +2e- Cd (4)Cd2+ +S2-
CdS↓
10、(08深圳宝安区一模)镉是银白色或有蓝色光泽的软质金属,具延展性,密度:8.642克/厘米3。熔点:320.9℃。沸点765℃。常见化合价为 +2价。不溶于水,溶于大多数酸中。在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍-镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用
 镉的生产流程如图示意如下:
镉的生产流程如图示意如下:
请回答下列问题:
 (1)写出步骤①反应的离子方程式
。
(1)写出步骤①反应的离子方程式
。
(2)步骤②所加入的金属的名称是 ,为了实现绿色化学的目标,应如何处理“溶液1”? 。
(3)步骤④用“溶液2”作电解液,镉在 极析出,该电极反应式是
。
(4)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝沉淀镉离子。写出加入硫化钠溶液沉淀镉离子的离子方程式 。
9、(1)78.0 100
(2)取滤液少许,加入NaOH溶液后加热,生成的气体能使润湿的红色石蕊试纸变蓝。
(3)Al(OH)3 Al2O3 Fe2O3 (4)K2SO4 (NH4)2SO4
(5)BaCl2 过滤 洗涤 干燥 (6)
9、(2008年上海高考27)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列天空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨) mL,用规格为 mL量筒量取。
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是 。
(3)写出沉淀物中所有物质的化学式 。
(4)滤液I的成分是水和 。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
mol(用含m、n的代数式表示)。
8、(1)S2- + H2O
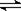 HS- +OH-
;HS- + H2O
HS- +OH-
;HS- + H2O 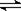 H2S +OH-;
H2S +OH-;
(2)2.7×10-3 ; (3)+172.5 ; (4)使BaSO4得到充分的还原(或提高BaS的产量);①②为吸热反应,炭和氧气反应放热维持反应所需高温。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com