
题目列表(包括答案和解析)
5.已知铅+2价稳定,6种物质:H2O、PbO2、Pb(NO3)2、HMnO4、HNO3和Mn(NO3)2可以组成一个化学方程式。下列有关说法正确的是 ( )
A.反应物中发生氧化反应的物质PbO2
B.被还原的元素是Mn(NO3)2中Mn
C.反应中1mol氧化剂得到5mol电子。
D.请将反应物配平后的PbO2与Mn(NO3)2系数之比5:2
4.生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:
2FeSO4·7H2O
 Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
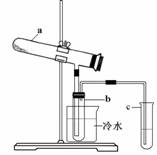
A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42-
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
3.下图为常温下向25mL 0.1 mol/L MOH溶液中逐滴滴加0.2 mol/LHA溶液过程中溶液pH的变化曲线。
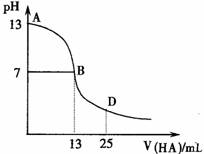
下列推断错误的是 ( )
A.MOH一定是强电解质
B.AB区间,c(OH-)>c(H+),则c(OH-)≥c(A-)
C.HA为弱酸
D.在D点时,溶液中c(A-)+c(HA)=2c(M+)
2.下列各组离子,在溶液中能大量共存,某溶液既能溶解Al(OH)3,又能溶解SiO2的一组是( )
A.K+、Na+、HCO3-、SO42- B.Na+、NO3-、Cl-、ClO3-
C.H+、Ca2+、CO32-、NO3- D.Ag+、K+、NO3- 、Na+
1.焰火“白鸽”、“笑脸”、“60”、 “青藏火车”等图案,让中华人民共和国成立60周年联欢晚会更加宏伟辉煌,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A.H2、S、C2H5OH在空气中燃烧均发出淡蓝色的火焰
B.欲观察CO燃烧的火焰颜色,燃气导管口的材料最好是钠玻璃
C.焰色反应均应透过蓝色钴玻璃观察
D.焰色反应操作:
20、(1)c,d (2)冷却结晶,引流 (3)NH3 (或NH3·H2O),b d
(4)注视凹液面的最低处与刻度线,凹液面的最低处与刻度线相平; 酸式。

20、(2009年高考山东30)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
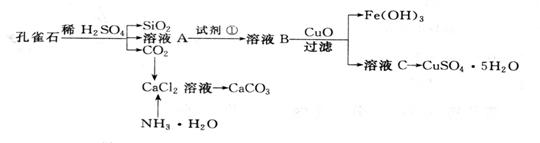
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a、KMnO4 b、(NH4) 2S c、H2O2 d、KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
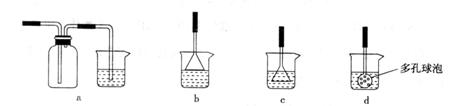
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列
装置回收(填代号)
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应
,直到 ;用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
19、(1)蒸馏法,电渗析法,离子交换法等。 (2)Cl2 NaOH,NaClO
(3)富集溴元素 (4)SO2 +Br2+2H2O = 4H++ 2Br-+SO42- 强酸对设备的严重腐蚀。
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分。④深红棕色;分液(或蒸馏)
19、(2009年高山考天津9)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
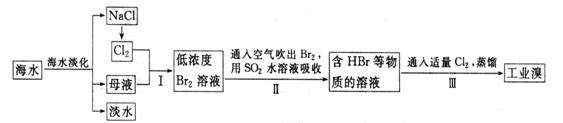
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 ,或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
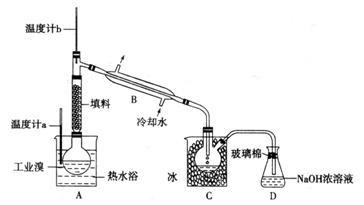 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:
。
②整套实验装置中仪器连接均
不能用橡胶塞和橡胶管,其原因是
。
③实验装置气密性良好,要达
到提纯溴的目的,操作中如何控制
关键条件:
。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
18、(1)Al2O3 + 6H+ = 2Al3++3H2O (2)SiO2 + 2OH-= SiO32 -+ H2O
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
(4)NaHCO3;制纯碱或做发酵粉等合理答案。 (5)5.6×10-10mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com