
题目列表(包括答案和解析)
27、下表由元素周期表的前三周期去掉副族上方空区域后组合而成,表中虚线处为IIA、IIIA族的连接处。请用相应的化学用语回答下列问题:

(1)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式___________________________________.

(2)上左图是第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar),则其中序列“2”原子的结构示意简图为________,“8”原子的电子排布式为_________。
(3)上右图是b、c、d、e、f的氢化物的沸点直角坐标图,序列“5”氢化物的化学式为____,序列“1”的氢化物的电子式:________。
26、现有下列第2、3周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,元素的非金属性越强,金属性越弱。X值相对较大的元素在所形成的分子中化合价为负价。
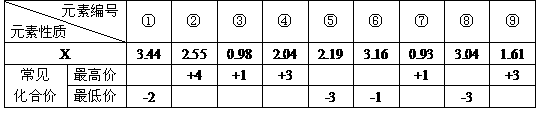
(1)写出元素⑥对应的原子的最外层轨道表示式 。元素①对应的原子的核外电子排布式 。
(2)元素⑦和元素⑨两种元素的氢氧化物反应的离子方程式为 。
(3)“神舟”五号飞船内需要有一种化合物来吸收航天员呼出的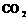 ,你认为该物质应该是由上表中的
(填序号)元素组成的。
,你认为该物质应该是由上表中的
(填序号)元素组成的。
(4)将8g元素②的单质在足量的元素①的单质中燃烧,所得气体通入1L1mol·L-1的NaOH溶液中,完全吸收后,溶液中离子浓度的大小顺序是 。
25、(1)以下结构中, 代表原子序数从1到10的原子的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2 )



A B C D
根据各图表示的结构的特点,写出该分子的化学式:
A_______________B______________C____________D_________________
 (2)在分子的结构中,由一个原子提供成键电子对而形成的共价键用 表示,例如:
(2)在分子的结构中,由一个原子提供成键电子对而形成的共价键用 表示,例如:
 O
O O
O
O O
H-O-S-O-H H C-N
O O O
硫酸 硝基甲烷
写出三硝酸甘油酯的结构式:____________________________
24、已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
②电子总数相同的氢化物的化学式和立体结构分别是
;
23、下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
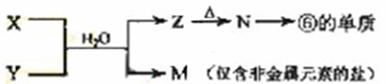
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
22、门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
第II卷(共84分)
21. 美国化学家在40GPa高压下,用激光器加热到1800K,制得了具有高熔点、高硬度的二氧化碳晶体。下列关于该晶体的说法正确的是( )
A.该晶体属于分子晶体,晶体中存在直线型二氧化碳分子
B.该晶体易气化,可用作制冷材料
C.一定条件下,该晶体可跟氢氧化钠反应
D.每摩尔该晶体中含4摩尔C-O键
20、下列事实能够用键能大小解释的是
A.单晶硅沸点比金刚石低 B.通常情况下,氮气的化学性质非常稳定
C.常温常压下甲烷与戊烷的状态不同 D.稀有气体一般难以发生化学反应
19、由短周期两种元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是
A.A2B3是三氧化二铝 B.A3+和B2-最外电子层上的电子数相等
C.A是第2周期第ⅢA族的元素 D.B是第3周期第ⅥA族的元素
18、短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子次外层电子数等于其原子核外电子总数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
A.C>D>B>A B.D>B>A>C
C.A>D>C>B D.B>A>C>D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com