
题目列表(包括答案和解析)
6、下列离子中,能使水的电离平衡发生移动的是 ( )
A :X+ 1s22s22p6 B:Y--1s22s22p63s23p6
C:Z3+ 1s22s22p6 D: M+ 1s22s22p63s23p6
5、下列溶液均是50ml,若分别向其中加入0.5mol/L盐酸,则溶液的导电性明显增强的是 ( )
A.0.5mol/L的H2SO4 B.0.5mol/L的NaOH
C.0.5mol/L的NH3·H2O D.0.5mol/L的AgNO3
4、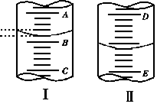 如右图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。
如右图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。
如果刻度A和D都是4,则两处液面的读数是:( )
A.Ⅰ中是3.2 mL,Ⅱ中是3.40 mL
B.Ⅰ中是4.8 mL,Ⅱ中是3.40 mL
C.Ⅰ中是3.2 mL,Ⅱ中是4.60 mL
D.Ⅰ中是4.8 mL,Ⅱ中是4.60 mL
3、在下列叙述中,正确的是 ( )(A)氯化钠溶液在电流作用下,电离成钠离子和氯离子。
(B)溶于水后,能电离出氢离子的化合物都是酸。
(C)二氧化硫溶于水,其溶液能导电,二氧化硫是电解质。
(D)在熔融状态下能导电的化合物,属于离子化合物。
2、室温下,等物质的量的下列溶液中,NH4+浓度最大的是 ( )
A:NH4CI B:NH4HSO4 C:NH4NO3 D:NH4HCO3
1、下列电离方程式中,错误的是 ( )
A.Al2(SO4)3→2Al3++3SO2-4 B.HF H++F-
H++F-
C.HI H++I- D.NaHCO3→Na++HCO-3
H++I- D.NaHCO3→Na++HCO-3
31、由A、D、E、G四种元素组成的化合物的分子式为AxDy(E2G4)Z。已知:
①x、y、z为整数,且x+Y+Z=7;
②取8.74g该化合物溶于水,加入酸和强氧化剂,化合物中的E、G元素完全转化成气态化合物EG22.688L(标准状况下),其密度为1.965g/LEG2能使澄清石灰水变浑浊;
③发生上述反应后A、D以阳离子存在于溶液中,往溶液中加入过量的铁粉,其中使D离子全部还原所消耗的铁粉质量为0.56g;
④化合物中D元素的百分含量为12.8%。试计算计算和推理填空:
⑴E、G、D、A四种元素的符号是:E ;G ;D ;A ;
⑵x、y、z的值依次为 、 、 。
⑶该化合物的分子式为 。
出题说明:本套试题是物质结构的基础题,物质结构是高考中的热点,主要分布在选择题和第四大题的填空题中,起点高、落脚低,关键要理清基本概念。学生目前在这部分内容中碰到的主要问题是基础知识不扎实,从题干中提取信息的能力较差。因此本套题的选择题主要考核同位素的概念;质子数、种子数、质量数的关系,化学键之间的比较、常用化学用语的表达,构成四类晶体的微粒间作用力及其对物质性质的影响;元素周期律和元素周期表的应用。填空题考核了化学用语的表达,结构对性质的影响,还考核了学生对信息的加工、整理以及表达等综合能力。
30、A、B、C、D为1-20号元素,根据性质推断它们在周期表的位置。
⑴A最高正价与负价绝对之比为3:1,其气态氢化物通常状态下为气体,其水溶液能被氧化产生黄色浑浊现象。
⑵B的最高价氧化物化学式为B2O5,其气态氢化物中含氢8.82%。
⑶0.9g由C元素组成的单质和足量的盐酸反应,生成CCl3和在标准状况下为1.12L的H2。
⑷D元素的最高氧化物的化学式为DO,其对应的水溶液中,通入CO2能生成白色沉淀,继续通入CO2,沉淀又消失。
29.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:用大小、外形均相同的铝片分别和H+浓度相同的稀盐酸、稀硫酸反应,铝片与稀盐酸反应放出气泡的速度明显快于与稀硫酸反应放出气泡的速度。是什么原因导致了反应现象的差异呢? 他从微观角度分析得出,H+浓度相同的盐酸、硫酸中,只是所含 不同。
他进行了如下实验探究:
|
组别 |
相同的铝片 |
H+浓度相同的酸 |
反应片刻后添加某种试剂(少量) |
添加试剂后的反应现象 |
结论 |
|
1 |
1g铝片 |
5mL盐酸 |
Na2SO4 |
无明显变化 |
和 离子对反应无影响 |
|
2 |
1g铝片 |
5mL硫酸 |
NaCl |
明显加快 |
离子对反应有促进作用 |
针对上述探究过程回答下列问题:
(1)请你将表格中的空格补充完整;(2)你认为原因可能是
(3)若将第2组实验中添加的试剂NaCl改为HCl气体,能否完成探究任务?请说明原因
28、(1)I.图表法、图象法是常用的科学研究方法。
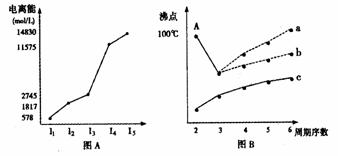 电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子。短周期某主族元素M逐个失去电子的电离能情况如图(A)所示。则M元素位于周期表的第 族
电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子。短周期某主族元素M逐个失去电子的电离能情况如图(A)所示。则M元素位于周期表的第 族
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: (填“a”或“b”),理由是: 。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻-硝基苯酚 |
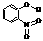 |
0.2 |
45 |
100 |
|
B |
对-硝基苯酚 |
 |
1.7 |
114 |
295 |
(3)下列物质的熔点高低顺序,正确的是___________
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com