
题目列表(包括答案和解析)
4.下列各选项所述的两个量,前者一定大于后者的是
①F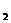 和Br
和Br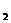 的沸点 ②纯水在25℃和80℃时的pH
的沸点 ②纯水在25℃和80℃时的pH
③同温下分别在100 g水中最多能溶解的无水CuSO 和CuSO
和CuSO · 5H
· 5H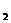 O的质量
O的质量
④25℃时,等体积且pH都等于5的盐酸和AlCl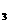 溶液中,已电离的水分子数
溶液中,已电离的水分子数
⑤在NH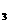 +NO-→ N
+NO-→ N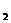 +H
+H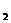 O(未配平)反应中,被氧化和被还原的N 原子数
O(未配平)反应中,被氧化和被还原的N 原子数
⑥耐火材料MgO和CaO的熔点 ⑦H 和H
和H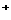 的离子半径
的离子半径
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
3.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,可以得到的正确结论是
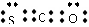 A.羰基硫属于非极性分子
A.羰基硫属于非极性分子
B.羰基硫的电子式为:
C.羰基硫沸点比CO2低
D.羰基硫分子中三个原子不在同一直线上
2.正确掌握化学用语是学好化学的基础。下列有关表述中正确的一组是
A.C2H4和C4H8两物质中碳的质量分数相同,它们一定是同系物
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.S2-的结构示意图为: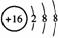 ,NH4Cl的电子式为:
,NH4Cl的电子式为: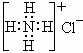
D.SiH4、CH4、NH4+的空间构型均为正四面体型;CO2、C2H2均为直线型
1.2006年9月28日,中国科学家研制的“人造太阳”成功地进行了一次放电。所谓“人造太阳”是指受控核聚变。从1 L海水中提取出来的氘(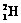 )受控核聚变成氦(
)受控核聚变成氦(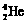 )时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
)时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
A.氘(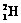 )受控核聚变成氦(
)受控核聚变成氦(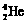 )是一种化学变化
)是一种化学变化
B.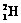 和
和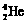 互为同位素
互为同位素
C.符号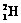 中的“2”与符号
中的“2”与符号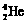 中的“2”意义不同
中的“2”意义不同
D.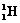 2和
2和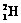 2的物理性质、化学性质都存在着很大的差异
2的物理性质、化学性质都存在着很大的差异
21.(12分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33°C)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第上电离能数据(单位:kJ·mol-1),回答下面各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”、“p”、“d”、“ds”等)区元素,位于 族。
若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
20.(10分)
 工业上利用NaIO3和NaHSO3反应来制取单质I2。NaIO3来源于自然界的矿物,NaHSO3则可利用硫酸工厂尾气处理(用NaOH溶液吸收SO2)的产物。
工业上利用NaIO3和NaHSO3反应来制取单质I2。NaIO3来源于自然界的矿物,NaHSO3则可利用硫酸工厂尾气处理(用NaOH溶液吸收SO2)的产物。
(已知:①HSO3-的还原性比I-强 ②IO3-+5I-+6H+=3I2+3H2O)
⑴配平下列化学反应方程式:
①□NaIO3+□NaHSO3-□NaI+□Na2SO4+□H2SO4
②□NaIO3+□NaHSO3-□I2+□Na2SO4+□H2SO4+□H2O
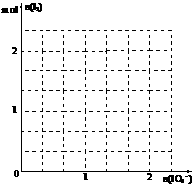
⑵现模拟工业制取I2。在含5molNaHSO3的溶液中
逐滴加入NaIO3溶液。请画出加入NaIO3的物质的量
和析出I2单质的物质的量的关系曲线。
⑶若工业上要生产I22.54吨,至少需要处理标准状况下
SO2的体积分数为0.224%的硫酸厂的尾气多少立方米?
19.( 11分)已知:
甲苯及其卤代物是有机化工的基本原料,由它出发可制造某些香料、药物及广泛应用于印刷、电子工业中的感光树脂的重要中间体,它们之间的关系如下图所示:
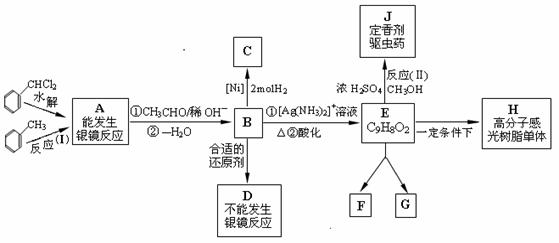 图中 B、D、E 都能使溴水褪色, E 在光等辐射能作用下可以发生二聚加成反应, 生成互为同分异构体的环状化合物 F 和 G; E 还可以在一定条件下形成一种优质高分子感光树脂的单体H。试回答:
图中 B、D、E 都能使溴水褪色, E 在光等辐射能作用下可以发生二聚加成反应, 生成互为同分异构体的环状化合物 F 和 G; E 还可以在一定条件下形成一种优质高分子感光树脂的单体H。试回答:
⑴ 写出有机物的结构简式: A______ ______、C_____ _____、D_____________。
⑵ 反应(I)的类型是______________,反应(II)的类型是______________。
⑶ 完成化学方程式: A→B:____________________________________________。
⑷ 同种类、互为同分异构体的 F 和 G 的结构简式为:F____ _________ G_______ ___。
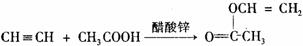 ⑸ 已知:
,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为_____ _______。
⑸ 已知:
,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为_____ _______。
17.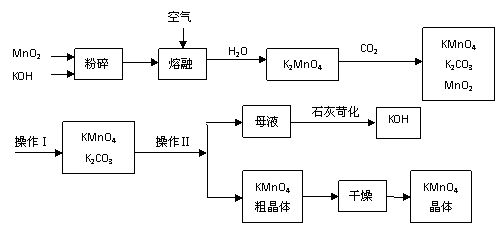 (11分)工业上制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(11分)工业上制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
①KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
③上述流程中可以循环使用的物质有 、 (写化学式)。
④若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
⑤该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) 。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
⑥操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
16.(8分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
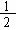 (1)某温度下,SO2(g)+ O2(g)
(1)某温度下,SO2(g)+ O2(g)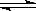 SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
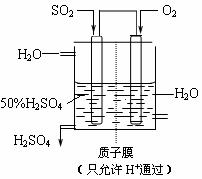 2SO2(g)+O2(g)
2SO2(g)+O2(g)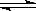 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以右图所示装置用电化学原理生产硫酸,
写出通入SO2的电极的电极反应式: 。
(4)若通入SO2的速率为2.24 L••min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为 mL••min-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com