
题目列表(包括答案和解析)
6.(12分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
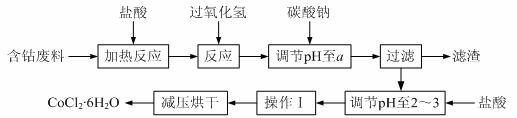
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 ▲ 。
⑵加入碳酸钠调节pH至a,a的范围是 ▲ 。
⑶操作Ⅰ包含3个基本实验操作,它们是 ▲ 和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是 ▲ 。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 ▲ 。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是 ▲ 。
5.(12分)FeCl 可通过多种途径转化成FeCl
可通过多种途径转化成FeCl 。(1)在FeCl
。(1)在FeCl 溶液中加入适量氢碘酸,发生反映的离子方程式为
溶液中加入适量氢碘酸,发生反映的离子方程式为
(2)工业上常将无水FeCl 在氮气做保护气下加热至300℃-350℃,通入干燥H
在氮气做保护气下加热至300℃-350℃,通入干燥H ,而制得FeCl
,而制得FeCl 。该反应的化学方程式为
。该反应的化学方程式为
(3)工业上另一种制备FeCl 的方法是:将无水的FeCl
的方法是:将无水的FeCl 与适量氯苯(C
与适量氯苯(C H
H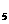 Cl),在130℃持续加热约3小时,可发生如下反应:
Cl),在130℃持续加热约3小时,可发生如下反应:
2 FeCl + C
+ C H
H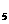 Cl
Cl 2 FeCl
2 FeCl + C
+ C H
H Cl
Cl + HCl
+ HCl
根据有机反应规律,该反应中氯苯发生的是 (填有机反应类型)。
(4)分析上述三个反应,下列有关说法正确的是 (填序号)。
①反应(1)中,氢碘酸既表现了酸性,又表现了还原性
②反应(3)中,HCl为氧化产物
③上述三个反应中,FeCl 均为还原产物
均为还原产物
(5)请另写一个FeCl 转化成FeCl
转化成FeCl 的化学方程式:
的化学方程式:
4.(10分)随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol·L-1时通常认为该离子沉淀完全)。
|
金属离子 |
Ksp |
pH(10-1mol·L-l) |
pH(10-5mol·L-l) |
|
Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
|
Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
|
Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
|
Ca2+ |
4.0×10-5 |
12.3 |
14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol·L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是__________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
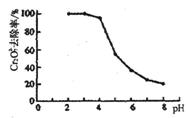 ①Cr2O72-转变为Cr3+的离子方程式为_______________________________。
①Cr2O72-转变为Cr3+的离子方程式为_______________________________。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:____________________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,
式中:co-理前废水中Cr2O72-的浓度, c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可
以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaS04)=9.1x10-6,Ksp (CaC03)=2.8x10-9]
3.(10分)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
 (2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:

根据所给信息判断,混合动力车上坡或加速时,乙电极周围
溶液的pH将_______(填“增大”、“不变”或“减小”),该
电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g)  CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
|
容器编号 |
c(CO)/mo1·L-1 |
c (02)/mol·L-1 |
c (C02)/mol·L-1 |
v(正)和v (逆) 比较 |
|
I |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)=v(逆) |
|
Ⅱ |
3.0×10-4 |
4.0×10-4 |
5.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中C0的浓度为_________mol·L-1。
2.英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会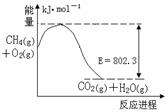 反过来加剧全球变暖。
反过来加剧全球变暖。
(1)下图是1molCH4和O2完全反应生成CO2气体与水蒸气过程中能量变化示意图,又已知 H2O(l)=H2O(g) △H=44.0kJ·mol-1, 请写出1molCH4和O2完全反应生成CO2气体与液态水的热化学方程式 。
 (2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
①请写出甲烷燃料电池中a极的电极反应式为 。
②此时电池内的总反应方程式为 。
(3)某课外活动小组利用如图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:

①CH4与Cl2发生反应的条件是
;若用日光直射,可能会引起

 。
。
②实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出, , 等。
③用饱和食盐水而不用水的原因是 。[
④实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体--光气,反应化学方程式为2CHCl3+O2 → 2COCl2+2HCl,上述反应  (填选项符号,下同)
(填选项符号,下同)
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸
D.水 E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
1.2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电 动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g)
CH3OH(g) +
H2O(g)  ΔH2
ΔH2
① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度[ |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③  H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
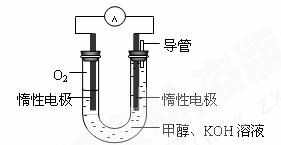 (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为 。
16.(历届12分) 用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
已知:①NO+NO2+2OH-=2NO2-+H2O②气体液化温度:NO2为0.21℃,NO为-152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为 。
(2)反应前先通入N2目的是 。
(3)确认气体中含NO的现象是 。
(4)装置F的作用是 。
(5)如果O2过量,则装置B中发生反应的化学方程式为: 。

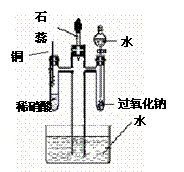 17(附加题).(15分) 为了证明NO可以与O2和H2O共同反应生成HNO3,某学生设计了以下装置按如下实验步骤进行实验
17(附加题).(15分) 为了证明NO可以与O2和H2O共同反应生成HNO3,某学生设计了以下装置按如下实验步骤进行实验
①检查装置气密性。
② 把中间四通直管中放入装有一定量水的水槽中,并向左右两侧试管及分液漏斗中加入图示试剂
③ 将铜丝插入稀硝酸,开始反应,一段时间后再铜丝从溶液中抽出。
④ 打开分液漏斗活塞,在试管中加入少量水,再立刻关闭。
⑤ 滴入几滴石蕊试液。
请你参与帮助解答以下问题
(1)步骤①中,如何检查该装置的气密性?
。
(2)步骤③中,当铜丝插入稀硝酸时,观察到的主要现象有:
。
(3)步骤④中,中间四通直管中,水面是否变化 (填:上升、下降、不变),写出此时变化的反应方程式: 。
(4)加入石蕊试液的作用是: 。
16.(应届12分) NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点。NO亦被称为“明星分子”,试回答下列问题:
(1)NO对环境的危害在于 (填以下项目的编号)。
A. 破坏臭氧层
B. 高温下能使一些金属被氧化
C. 造成酸雨
D. 与人体血红蛋白结合
(2)在含Cu+离子酶活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝根离子在酸性水溶液中反应的离子方程式 。
(3)在常温下,将NO气体压缩到1.01×107Pa,在一个体积固定的容器里加热到50℃。发现气体的压强迅速下降,压强降至略小于原压强2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式。
___________________________________________________________________
(4)解释(3)中为什么最后的气体总压强小于原压强的2/3?
______________________________________________________________________。
15.(历届14分)为了研究铜与硝酸反应,化学兴趣小组设计了如下实验装置,其中a、b、c是活塞。
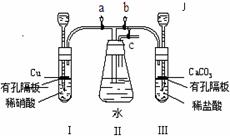
(1)装药品前,按图装置连接后,如何检验气密性?
______________________________________________________________________。
(2)按图装药品后,如果开启a和c,关闭b,则II中的现象是
______________________________________________________________________。
(3)如果将I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,过一会观察,可以看到II里没入水中的导管有气泡冒出,导管内气体呈红棕色,液面上气体为无色,试用文字及方程式解释这一现象:____________________________________________。
(4)在实验(2)中,要使II里的气体始终保持无色,应该怎样操作?
______________________________________________________________________。
(5)在实验(2)中,如果装置I、II里液面上空间的总体积为VmL,空气中氧气的体积分数为21%,实验在标准状况下进行,全部氧气通过反应转化为硝酸;实验开始时加入的铜为mg,实验完毕后剩余的铜为ng,II中所得溶液的体积也是VmL(不考虑装置外空气的可能进入)。则II中所得溶液的物质的量浓度是______________。
14.(7分)某校同学为探究Br 、I
、I 和Fe
和Fe 的氧化性强弱,进行了如下实验。
的氧化性强弱,进行了如下实验。
实验①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl , 振荡后静置,观察到下层液体呈紫红色;
, 振荡后静置,观察到下层液体呈紫红色;
②取少量FeSO 溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生氧化还原反应的离子方程式__________________________;
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是(填序号)_________;
A.Br >I
>I B.Fe
B.Fe >Br
>Br C.Br
C.Br >Fe
>Fe D.I
D.I >Br
>Br
(3)已知Fe 的氧化性强于I
的氧化性强于I ,请你从所给试剂中选择所需试剂,设计一个实验加以证明。①FeCl
,请你从所给试剂中选择所需试剂,设计一个实验加以证明。①FeCl 溶液 ②碘水 ③KI溶液 ④稀H
溶液 ②碘水 ③KI溶液 ④稀H SO
SO ⑤淀粉液
⑤淀粉液
(友情提示:请写出实验步骤、现象及结论)_________________________________
____________________________________________________________________________。
15(应届14分).铵盐受热分解,如图实验
 装置是验证氯化铵受热产生的气体是
装置是验证氯化铵受热产生的气体是
氨气和氯化氢,并将产生的气体重新
化合生成氯化铵。
(1)U形管B处所盛放的固体物质是 。
(2)证明氯化铵受热产生的气体是氨气和氯化氢的① ,当 说明有HCl生成,② ,
当 说明有NH3生成。
(3)若要在乙瓶中观察HCl和NH3重新化合生成NH4Cl的实验现象,请依据以上的实验装置写出有关的实验步骤和实验现象。
____________________________________________________________________________________________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com