
题目列表(包括答案和解析)
7.有人认为CH2 = CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2 = CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2 = CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是
A.BrCH2CH2Br B.ClCH2CH2Cl C.BrCH2CH2I D.BrCH2CH2Cl
6.在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是
①滴有石蕊的H2SO4溶液 ②滴有酚酞的氨水溶液
③滴有酚酞的氢氧化钠溶液 ④滴有酚酞的饱和氢氧化钙溶液
⑤滴有酚酞的Na2CO3溶液 ⑥溶有SO2的品红溶液
A.②⑥ B.②④ C.①③⑤ D.②④⑥
5.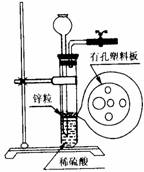 右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是
右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是
①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液
④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A.①③⑤
B.②⑥
C.③⑤
D.①②④
4.在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.用50mL 8mol/L的浓盐酸与10g二氧化锰共热制取氯气
B.向100mL 3mol/L的硝酸中加入5.6g铁
C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
D.在5×107 Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨
3.在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高B
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.称量时误用“左码右物”
2.NA表示阿伏加德罗常数,下列叙述正确的是
A.如果5.6LN2含有n个氮分子,则阿伏加德罗常数一定约为4n
B.46gNO2和N2O4混合气体中含有原子数为3NA
C.含有1mol碳原子的金刚石,C-C共价键数为2NA
D.常温下1mol氯气与熟石灰完全反应转移电子数为2NA
1.化学用语是学习化学的重要工具。下列用用来表示物质变化的化学用语中正确的是
A.K37C1O3与浓盐酸(HC1)在加热条件时生成氯气的化学方程式:
K37C1O3+6HC1=K37C1+3C12↑+3H2O
B.表示氢气燃烧的热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
|
Fe3++3H2O
Fe(OH)3(胶体)+3H+
D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
9.(8分)在汽车上安装三效催化转化器,可使汽车尾气中的主要
污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
⑴已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= ▲ 。
⑵某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。


①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、 ▲ 等必须相同。
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。空燃比约为 ▲ 时,催化剂对汽车尾气的催化效果最好。
⑶CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
下列说法错误的是 ▲ 。
 A.负极的电极反应式为:CO+O2-―2e-=CO2
A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
8. (10分)某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
(10分)某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)= 。
(2)该反应的化学平衡常数表达式为 。
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号)
a.0.82mol•L-1 b.0.25mol•L-1 c.0.20mol•L-1 d.0.08mol•L)
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡 移动(填“向右”、“向左”或“不”),化学平衡常数 (填“增大”、“减少”或“不变”)。
 (5)
其它条件不变,在第5min末将容器的体积缩小
(5)
其它条件不变,在第5min末将容器的体积缩小
一半,若第8min达到新的平衡(此时NH3的物
质的量约为0.25mol),请在上图中画出第5min
末到此平衡时NH3物质的量浓度的变化曲线。
7. (15分)工业上电解饱和食盐水能制取多种化工原料,其产品在工业上有许多重要用途。
(15分)工业上电解饱和食盐水能制取多种化工原料,其产品在工业上有许多重要用途。

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(1)工业上电解食盐水时,食盐必须精制,为了有效的除去Ca2+、Mg2+、SO42-离子,加入试剂的合理顺序为(选填下列选项序号)____;干燥塔中使用的液体干燥剂是______;
① 先加NaOH溶液,后加Na2CO3溶液,再加BaCl2溶液,过滤,最后加盐酸至中性
② 先加NaOH溶液,后加BaCl2溶液,再加Na2CO3溶液,过滤,最后加盐酸至中性
③ 先加BaCl2溶液,后加NaOH溶液,再加Na2CO3溶液,过滤,最后加盐酸至中性
(2)已知标况下11.2 L 阴极产生的气体在阳极产生的气体中完全燃烧时放出92.3 kJ的热量,则该反应的热化学方程式为:____________________________________________
(3)工业隔膜法电解食盐水的电解槽分为阴极区和阳极区,以防止NaOH和Cl2反应。假设采用无隔膜电解槽在常温下电解食盐水,其产物能充分接触,则总反应的化学方程式为:______________________________
(4)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用之一就是制气相白炭黑(与光导纤维的主要原料相同)。其制法是在高温下SiCl4与H2和O2反应,产物有两种,反应的化学方程式为: _______;
(5)聚氯乙烯(Polyvinyl Chloride,简称PVC),是我国第一、世界第二大通用型合成树脂材料,由于具有优异的抗燃性、耐磨性、抗化学腐蚀性、综合机械性、制品透明性、电绝缘性及易加工等特点,目前PVC已经成为应用领域最为广泛的塑料品种之一。按上述生产流程,理论
上每生产125
t 聚氯乙烯,需消耗精盐____________ t 。

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com