
题目列表(包括答案和解析)
2、某酸的酸式盐NaHY的水溶液显碱性,下列有关叙述正确的是 ( )
A.H2Y在电离时为:H2Y==2H++Y2-
B.在该盐的溶液里,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在该盐的溶液里,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(H+)
D.HY一水解方程式为:HY一+H2O ==H3O++ Y2-
1.下列关于蛋白质的叙述中,正确是 ( )
A.蛋白质溶液里加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解
B.在豆浆中加少量石膏,能使豆浆凝结为豆腐
C.温度越高,酶对某些化学反应的催化效率越高
D.任何蛋白质遇到浓HNO3 都会变成黄色
17. (13分)实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
(13分)实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4( )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是
(用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
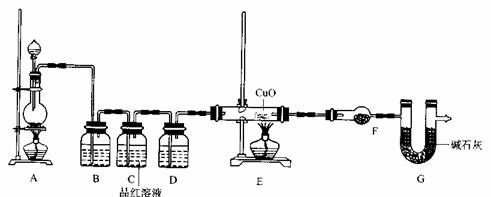
①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 .
[2010枣庄一模]
16.(8分)(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据你掌握的知识判断,下列实验操作的描述中,正确的是 。(填写下列各项序号)
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
E.Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中
F.将用水润湿的pH试纸,浸人稀盐酸溶液,测定溶液的pH
(2)化学实验中,不正确的操作会对实验结果的准确性造成一定的影响,请用“>”、“<”或“一”填写下列空白:
①实验时未用标准液润洗滴定管,则测得锥形瓶中待测液的浓度 实际浓度。
②用托盘天平称取10.4 g氯化钠,若将砝码和氯化钠的位置放颠倒了,所称取氯化钠的质量为 10.4 g。
③用容量瓶配制500 mL0.1 mol·L-1。NaOH溶液,定容时仰视刻度线,所得溶液的物质的量浓度 0.1 mol·L-1。
17.(13分)
(1)(4分)H2(2分);随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2
Zn+H2SO4===ZnSO4+H2↑(2分)
(2)(9分)
①NaOH溶液(或KMnO4,其它合理答案也给分,1分)
除去混合气体中的SO2。(2分)
②浓硫酸(1分) 无水硫酸铜(1分)
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色(2分)
④防止空气中H2O进入干燥管而影响杂质气体的检验(2分)
①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
 (三)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示);
;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
(三)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示);
;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
①
② 试
9.现有一定量含有NaOH杂质的Na2O2试样5.00 g,分成等质量两份,用两种方法测定Na2O2试样的纯度。请填写下列空白:
 (1)第一种方法:取第一份试样,从下图中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度(可供选用的反应物只有CaCO3固体、MnO2固体、6 mol·L-1盐酸和蒸馏水).
(1)第一种方法:取第一份试样,从下图中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度(可供选用的反应物只有CaCO3固体、MnO2固体、6 mol·L-1盐酸和蒸馏水).
①若实验要求装置尽可能简单,应选用上图中的装置是(只要求写出图中装置的标号) 。
②所选用装置的连接顺序应是(填各接口的字母;连接胶管略). 。
 ③若实验过程中共产生氧气140 mL(已折算成标准状况),则试样中过氧化钠的纯度为 。
③若实验过程中共产生氧气140 mL(已折算成标准状况),则试样中过氧化钠的纯度为 。
(2)第二种方法:取第二份试样,配成250.00 mL溶液,用0.255 0 mol·L-1的标准盐酸滴定。
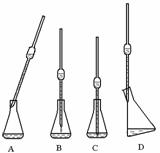
① 取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图 ,
取溶液所用仪器的名称是 。
② 滴定操作平行实验的数据记录如下表:
|
|
第一次滴定 |
第二次滴定 |
第三次滴定 |
|
消耗标准盐酸的体积(mL) |
24.98 |
25.00 |
25.02 |
由表中数据计算样品中Na2O2纯度为 。
(3)若上述两个实验中不存在重大的操作失误,测得的实验数据也是真实可靠的,但以上两种方法测得的Na2O2纯度数据误差较大。
① 你认为上述两种方法中,哪种方法更为可靠 ?
② 产生较大实验误差的原因最可能是 。
③ 在题中所给出的仪器和药品范围内,如何用简单的方法加以改进,使实验误差大为减少,写出改进的方法 。
试 烧瓶中发生反应的离子方程式为 ;
请根据实验目的将装置I中虚线框内装置补充完整并在括
 号内注明所需试剂;试
号内注明所需试剂;试
0.01 mol·L-1AgNO3溶液,下列叙述正确是
A.混合溶液中c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
B.混合溶液中c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中 约为1.02×103
约为1.02×103
16. 已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)
为1.25×10-5 mol·L-1。若在5mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8mL
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-)
B.0.1mol·L-1的NaHCO3溶液中:c(Na+) = c(HCO3-) + c(H2CO3)+ 2c(CO32-)
C.0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com