
题目列表(包括答案和解析)
1.(16分,每空2分)
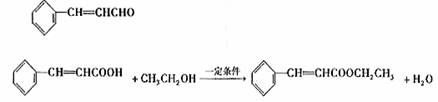 (1)C9H8O
(1)C9H8O
(2)①
② D (1分)
③
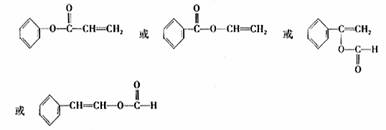 ④ 4(1分)
④ 4(1分)
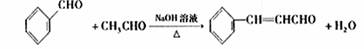 (3)①CH2=CH2或CH=CH
(3)①CH2=CH2或CH=CH
②
③乙酸乙酯
1.(16分)肉桂醛在食品、医药化工等方面都有应用。
(1)质谱分析肉桂醛分子的相对分子质量为132。其分子中碳元素的质量分数为81.8%,其余为氢和氧。分子中的碳原子数等于氢、氧原子数之和。肉桂醛的分子式是
。
 (2)肉桂醛具有下列性质:
(2)肉桂醛具有下列性质:
请回答:
①肉桂醛是苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的氢原
子,其结构简式是 。(本题均不考虑顺反异构与手性异构)
②Z不能发生的反应类型是 。
A.取代反应 B.消去反应 C.加成反应 D.加聚反应
③Y与乙醇在一定条件下作用得到肉桂酸乙酯,该反应的化学方程式是 。
④Y的同分异构体中,属于酯类目苯环上只有一个取代基的同分异构体有 种。
其中任意一种的结构简式是 。
(3)已知
I.醛与醛能发生反应,原理如下:
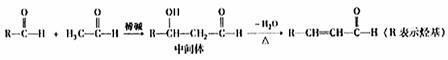
II.合成肉桂酸醛的工业流程如下图所示,其中甲烷。
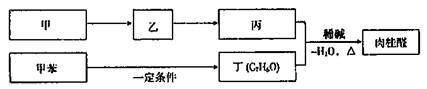
请回答:
①甲的结构简式是 。
②丙和丁生成肉桂的化学方程式是 。
③醛和酯也可以发生如“I”的反应。食用香料肉桂酸乙酯通过如下反应合成:

戊的名称是 。
33.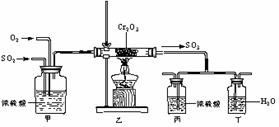 (8分)下面的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
(8分)下面的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
(1)写出工业上用FeS2制取SO2反应的化学方程式___________________。
(2)写出上图中部分装置的作用:甲:混合SO2和O2;_________________;______________。丁:________________________。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有任何变化,产生这种现象的可能原因是:①插入浓H2SO4溶液的导管太深,导致两个吸收瓶内的压强差较大,SO3从水中冒出来了,与水形成酸雾;②____ ___________。
(4)上图中甲、乙、丙、丁仪器分别相当于工业制取硫酸的装置中甲乙__ ___;丙丁_ __。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
32.(8分)在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高,E、F、G、H四种元素处于同一周期,F的最高价氧化物对应的水化物酸性在同周期中是最强的,G的电离能介于E、F之间,H与F相邻。
(1)写出下列元素符号:B ,H 。
(2)B元素在周期表中的位置 。
(3)A、C、D三种元素形成的简单离子的半径由大到小的顺序是(写离子符号) 。
(4)E、F、G三种元素的第一电离能由大到小的顺序是(写元素符号) 。
(5)B元素基态原子的电子排布式为 。
(6)H和F形成一种超英、耐磨、耐高温的新型化合物,该化合物属于 晶体,其硬度比金刚石 (填“大”或“小”)。
化学与技术模块
有机化学基础模块
31.(8分)八角主要产于中国和越南,是我国人民常用的烹调香料。从八角中可以提取到莽草酸,它是制取抗禽流感药的基本原料。八角本身没有杀禽流感病毒的能力,从八角提取的莽草酸,再经过十几步反应得到的Tamiflu (达菲)才是抗禽流感病毒药。莽草酸与达菲的结构式如下:
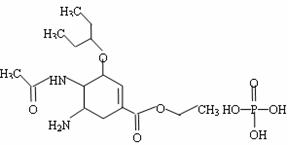
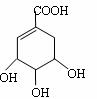
达菲 (莽草酸)
达菲的化学成分为:磷酸奥斯他韦,简称 磷酸OS 分子式:C16H28N2O4•H3 PO4
试根据莽草酸结构回答下列问题:
(1)请写出莽草酸的分子式: 。
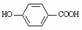 (2)请写出莽草酸分子结构中含有的官能团名称:
。
(2)请写出莽草酸分子结构中含有的官能团名称:
。
(3)莽草酸在浓硫酸作用下加热可以得到B(B的结构简式为: 其反应类型为:_______________;
(4)1mol莽草酸和足量的NaOH反应,消耗的NaOH的物质的为: 。
请写出有关的化学方程式: 。
(5)B的同分异构体中既含有酚羟基又含有酯基的共3种,写出其中一种同分异构体的结构简式______________________________。
(6)1mol莽草酸和足量的CH3COOH反应,消耗的CH3COOH物质的量为: 。
请写出有关的化学方程式: 。
物质结构与性质模块
29.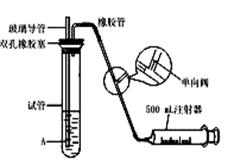 (16分)SO2是主要的大气污染物之一,为了粗略地测量-周围环境中SO2的含量,某学生课外活动小组设计了下图的实验装置。
(16分)SO2是主要的大气污染物之一,为了粗略地测量-周围环境中SO2的含量,某学生课外活动小组设计了下图的实验装置。
(1)检查该装置的气密性时,先在试管中加入适量水, 使 玻璃管末端浸没在水中,然后________(填写操作方法),若看到________(填现象)时,表明装置气密性良好。
(2)向试管中加入5×10-4 mol·L-1的碘水1.0 mL,用适量蒸馏水稀释后再滴入2~3滴淀粉溶液,配制成溶液A,测定指定地点空气中SO2含量时,推拉注射器的活塞,反复抽气,当溶液________(填颜色变化情况)时,可认为反应恰好完全进行,此时停止抽气,该反应的化学反应方程式是_________。
(3)我国环境空气质量标准中对SO2含量的最高限值如下表:
|
浓度限值/mg·m-3 |
||
|
一级标准 |
二级标准 |
三级标准 |
|
0.15 |
0.50 |
0.70 |
该学生活动小组分成了第一和第二两个实验小组,使用相同的实验装置和溶液A,在同一地点测定空气中SO2含量,当恰好完全反应时,记录抽气次数为:第一小组120次,第二小组140次(假定每次抽气均为500 mL),据此可计算出空气中SO2含量,第一小组结果为________mg·m-3,第二小组结果为________mg·m-3。
(4)你认为第________小组的实验更接近实际情况,该地空气中SO2含量属________级标准,如两小组所用药品和装置均无问题,你认为导致另一小组实验误差较大的主要原因可能是_______________。
28.(14分)氨和联氨又叫肼(N2H4)都是氮元素的重要氢化物,在工农业和航天工业都有重要的用途。请回答下列问题:
⑴在结构上N2H4和NH3的关系犹如H2O2和H2O的关系。N2H4能发生下列反应:
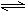 N2H4+H3O+==
N2H5++H2O N2H4+H2O N2H5++OH-
N2H4+H3O+==
N2H5++H2O N2H4+H2O N2H5++OH-
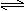
 N2H5++H2O N2H6++OH-
N2H5++H2O N2H4+H3O+
N2H5++H2O N2H6++OH-
N2H5++H2O N2H4+H3O+
据此可得出的结论是______________________。(填写序号)
A.肼水解显酸性 B.肼在水中能电离出H+
C.肼可看作是二元弱碱 D.肼可看作是二元弱酸
⑵液态氨类似水,也能发生微弱电离且产生电子数相同的两种离子,试写出液态氨的电离方程式 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式: ______________________________________。
⑶25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度 (填“大于”、“等于“或“小于”)0.1 mol·L-1 NaOH溶液中水的电离程度。若将0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 NH4NO3溶液等体积混合,所得溶液中离子浓度由大到小的顺序为___________________________。
⑷完成并配平下列反应的化学方程式:
______NH3+______NaClO - ______NaCl+______N2H4+_________
⑸火箭推进飞船升空时,主要利用肼和氧化剂反应释放出大量的热和快速产生大量气体。发射火箭用肼作燃料,NO2作氧化剂,发生反应时生成氮气和气态水。
已知2 g N2H4(g)完全反应时共放出35.5 kJ的热量,试写出该反应的热化学方程式
。
27.(12分)某校化学小组学生进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。
步骤如下
|
|
|
|
|||||||
|
|||||||
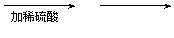 |
|||||||
 |
|||||||
步骤①观察到的现象是 。步骤③的主要操作包括: 。
(2)硫酸铜溶解度的测定:用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式是 。已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是 。
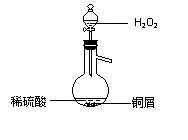 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如右图,验证该实验,该反应的化学方程式是
。
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如右图,验证该实验,该反应的化学方程式是
。
若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得到的结论是
。
15.下列离子方程式书写正确的是( )
A.向碳酸氢钠溶液中滴加氢氧化钡溶液
2HCO3- + Ba2+ + 2OH- = BaCO3↓ + CO32- + 2H2O
B.向沸腾的20mL水中滴入1mL饱和氯化铁溶液
Fe3+ + 3H2O = Fe(OH)3 ↓+ 3H+
C.向碳酸氢镁溶液中加足量的氢氧化钠溶液
Mg2+ + 2HCO3- + 2OH- = MgCO3↓+ CO32- + 2H2O
D. 硫酸铁的酸性溶液中通入足量硫化氢
Fe3+ + H2S = Fe2+ +S↓+2H+
第II卷 非选择题 必做题部分
14.下列说法正确的是( )
A.由一种元素组成的物质肯定为纯净物
B.离子化合物和共价化合物中都可能含有非极性键
C.核外电子排布完全相同的两种微粒,其化学性质一定相同
D.得电子越多的氧化剂,其氧化性就越强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com