
题目列表(包括答案和解析)
4.(16分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
 N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氧气的
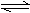 物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
 2N2O3 4NO2(g)
△H>0下表为反应在T1温度下的部分实验数据
2N2O3 4NO2(g)
△H>0下表为反应在T1温度下的部分实验数据
|
Vs |
0 |
500 |
1000 |
|
c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O3的电极反应式为 。
3.(14分)
(1)a c ………………………………………………………………2分
(2)2Fe2++H2O2+2H+=2Fe3++2H2O ………………………………3分
(3)10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O ………………3分
(4)Fe(OH)3-3e-+5OH-=FeO42-+4H2O …………………………3分
1 ……………………………………………………………3分
3.(14分)E和M均为生活中常见的金属元素。现有如下反应关系:
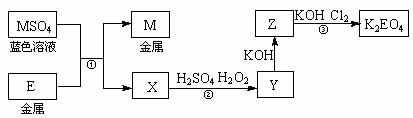
(1)反应①的反应类型是____________________(填序号)。
a.氧化还原反应 b.复分解反应 c.置换反应
(2)Y的溶液可使KSCN溶液显红色。反应②的离子方程式是____________________。
(3)K2EO4为高效绿色净水剂,可通过反应③制得。反应③的化学方程式是
____________________。
(4)用K2EO4和Zn作原料的电池是一种新型可充电电池,该电池长时间保持稳定的放电电压。其总反应可写成:3Zn+2K2EO4+8H2O 3Zn(OH)2+2E(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5 g Zn时转移 mol电子。
3Zn(OH)2+2E(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5 g Zn时转移 mol电子。
2.(每空2分,共12分)
(1)NO +Al+H2O→Al(OH)3+N2+OH- 5:3
+Al+H2O→Al(OH)3+N2+OH- 5:3
(2)2H2O+O2+4e-=4OH-
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积。
(3)2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol
(4)2.016
2.(12分)(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH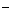 、Al(OH)3、NO
、Al(OH)3、NO 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
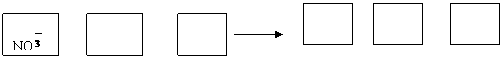
+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s)
△H=234.1kJ/mol
CO2(g)+2Fe(s)
△H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
 (4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
1.(每空2分,共12分)
(1)2周期VA族
(2)3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O;NaNO2
(3)-173.4kJ·mol-1;ab
(4)1:3
1.(12分)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是 。
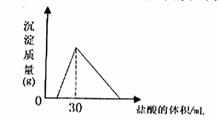
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1②CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
 根据①和②,标准状况下,4.48LCH4恰好将NO2
根据①和②,标准状况下,4.48LCH4恰好将NO2
转化为N2时,△H= 。
关于①和②,下列说法正确的是 (填字母)。
a. 由于反应①可推知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)
△H<-574kJmol
b. 等物质的量的甲烷分别发生反应①、②,
转移电子数相同
c. 右图可表示①的反应过程和能量关系
(4)同温同压下,3.5LNH3恰好将3.0L NO和NO2的混合气完全转化为N2,原混和气中NO和NO2的体积比是 。
95、含2molH2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生NA个SO2气体分子( )
1--5: √√√√√ 6--10:√√√√√ 11--15:×××××
16--20:××√×× 21--25:√×××× 26--30:√×√××
31--35:××××× 36--40:×√×√× 41--45:√√×√√
46--50:×××√× 51--55:√×××√ 56--60:×√√√×
61--65:√√××× 66--70:√××√× 71--75:×√×××
76--80:×××√× 81--85:×××√× 86--90:×××××
91--95×××××
94、含n molHCl的浓盐酸与足量MnO2反应可生成n NA /4 个氯分子( )
93、标准状况下,11.2 LNH3和11.2 LHCl混合后分子总数为NA( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com