
题目列表(包括答案和解析)
12、(1)B

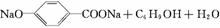
12. 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为:

(1)用没食子酸制造墨水主要利用了 类化合物的性质(填代号)。
A.醇 B.酚 C.油脂 D.羧酸
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为 。
(3)尼泊金丁酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为 ,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有 种。
(4)写出尼泊金丁酯与氢氧化钠溶液加热反应的化学方程式: 。
11、(1)胃液中的盐酸具有多种功能,为胃蛋白酶提供所需要的酸性环境,它还可使食物中的蛋白质变性,易水解,还能杀死随食物进入胃部的细菌。此外盐酸进入小肠后,可促进胰液和胆汁的分泌,又有助于对铁和钙的吸收。
(2)C
(3)黏膜下层 B (4)Mg2Si3O8·nH2O+4HCl 2MgCl2+3H2SiO3
+(n-1)H2O
2MgCl2+3H2SiO3
+(n-1)H2O
11.人的纯净胃液是一种无色而呈酸性的液体,pH在0.9-1.5之间,胃液中含有大量盐酸,其中的H+浓度比血液中的H+浓度高几百万倍,试回答下列问题:
(1)胃液中含有大量盐酸的意义是什么?
(2)若胃液酸度增高就会患胃酸过多症,下列物质不适宜用作治疗胃酸过多的药物的主要成分的是 。
A.小苏打粉 B.氢氧化铝粉 C.氧化钙粉 D.纯碳酸钙粉
(3)胃镜检查发现胃有少量出血,说明胃溃疡已深及 (填结构);胃溃疡患者胃酸过多可考虑选用(2)中的 。
(4)三硅酸镁晶体(Mg2Si3O8·nH2O)是一种常见的用来治疗胃溃疡的药物,该药物不溶于水,但能和胃酸反应,且作用持久。写出该药物和胃酸反应的化学方程式 。
10、(1)C18H20N2O6 不能 (2)D (3)5 加成
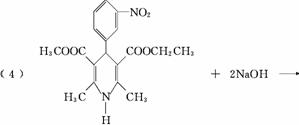
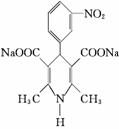
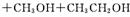
10、尼群地平片可用于治疗高血压。其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用。它的主要成分的结构如下:
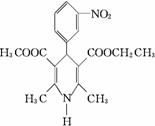
试根据结构回答下列问题:
(1)该物质的分子式为 , (填“能”或“不能”)溶于水。
(2)下列对该物质的描述不正确的是 ( )
A.在一定条件下能发生取代反应 B.能在酸性条件下发生水解反应
C.能和溴水发生加成反应 D.能发生银镜反应
(3)该物质在镍催化的条件下最多可以和 mol氢气发生 (填反应类型)反应。
(4)请写出尼群地平片的主要成分与足量的氢氧化钠溶液反应的方程式 。
9、(1)B (2)C
(3)5KI+KIO3+6HCl 6KCl+3I2+3H2O 5∶1 溶液变蓝
6KCl+3I2+3H2O 5∶1 溶液变蓝
(4)阳极:I-+3H2O-6e- IO
IO +6H+ 阴极:6H2O+6e-
+6H+ 阴极:6H2O+6e- 3H2+6OH-
3H2+6OH-
9、碘缺乏症遍及全球,多发生在山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者约有1 000万人左右。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐中加碘(KIO3)。据此回答下列问题。
(1)碘是合成下列哪种激素的主要原料之一 ( )
A.胰岛素 B.甲状腺激素 C.生长激素 D.糖尿病
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患 ( )
A .甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.雄性激素
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为 ,
氧化产物与还原产物的物质的量之比为 ,能观察到的明显现象是 。
(4)已知KIO3可用电解方法制得。原理是以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应化学方程式为KI+3H2O KIO3+3H2↑,则两极反应式分别为阳极
,阴极
。
KIO3+3H2↑,则两极反应式分别为阳极
,阴极
。
8、(1)常量 微量 (2)HClO4 同素异形体 (3)K Na和Ca (4)D C
8、在探索生命奥妙的过程中,科学家日益认识到生物细胞的组成和元素周期律有着密切的联系。约占人体总质量99.97%的11种元素全部位于周期表的前20号元素之内。其余0.03%是由十多种人体不可缺少的元素组成。
(1)根据在人体内含量的高低,人体必需的元素分为 元素和 元素。
(2)其中最高价氧化物对应的水化物中酸性最强的是 ;
与它处于同一周期的还有一种非金属元素S,S元素形成的单质有S2和S4等,S2和S4互为 。
(3)属于人体必需元素,且位于周期表前四周期的原子半径最大的元素是 ,它的相邻元素是 。
(4)下列元素摄入不当引起的症状依次为:多氟 ,缺锌 (填写序号)。
A.龋齿 B.甲状腺肿大 C.抵抗力差 D.氟斑牙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com