
题目列表(包括答案和解析)
13、(1)C<O<N
(2)三角锥型,SP3 (3)  ,N2O
,N2O
(4)[Cr(NH3)4 (H2O)2]Cl3
13、已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 ;
(2)B的氢化物的分子空间构型是 ,其中心原子采取 杂化;
(3)写出化合物AC2的电子式 ,一种由B、C组成的化合物与AC2互为等电子体,其化学式为 ;
(4)ECl3形成的配合物的化学式为 。
12、(1)E (2)D (3)B (4)A (5)A
12、根据下列五种元素的电离能数据(单位:kJ/mol),回答下列问题
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是 ;
A、Q和R B、S和T C、T和U D、R和T E、R和U
(2)电解它们的熔融氯化物,以下过程最可能正确的是 ;
A、Q2++2e-→Q B、R2++2e-→R
C、S3++3e-→S D、U++e-→U
(3)它们的氯化物的化学式,最可能正确的是 ;
A、QCl2 B、RCl C、SCl3 D、TCl
(4)S元素最可能是 。
A、S区元素 B、稀有气体元素 C、p区元素 D、过渡金属
(5)下列元素中,化学性质和物理性质最像Q元素的是 。
A、氦(1s2) B、铍(1s22s2) C、锂(1s22s1) D、氢(1s1)
11、(1)D,4,原子 (2)E,2 (3)B,分子,12 (4)金刚石>CsCl>干冰
11、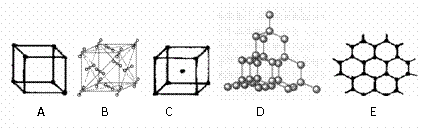 下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分
下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分
(1)其中代表金刚石的是(填编号字母,下同) ,金刚石中每个碳原子与 个碳原子最接近且距离相等。金刚石属于 晶体;
(2)其中代表石墨是 ,其中每个正六边形占有的碳原子数平均为 个;
(3)代表干冰的是 ,它属于 晶体,每个CO2分子与 个CO2分子紧邻;
(4)上述B、C、D三种物质熔点由高到低的排列顺序为 。
10、(12分)(1)离子键;离子晶体 (2) ;H-O-H;极性
;H-O-H;极性
(3)NaCl为离子晶体,HCl为分子晶体
10、(12分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排由式为ns1,且原子半径是同族元素中最小的。
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见右表(kJ·mol-1):
请回答:
(1)Z2Y中含有的化学键类型为 ,Z2Y2的晶体类型为 。
(2)ZYX的电子式为 ,X2Y的结构式为 ,XWY属于 (填“极性”或“非极性”)分子。
(3)晶体ZW的熔点比晶体XW的明显高的原因是
。
9、 (09涡阳二中14分)
(09涡阳二中14分)
(1)H2(2分),S (2分)
(2) (2分),离子键、共价键(各1分);
(2分),离子键、共价键(各1分);
(3)H2O分子之间存在氢键(2分)
(4)ClO-+H2O
 HClO+OH-(2分),2NaClO=2NaCl+O2↑(2分)
HClO+OH-(2分),2NaClO=2NaCl+O2↑(2分)
9、(09涡阳二中14分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为 ,D元素的原子结构示意图为 。
(2)由A、B、C三种元素形成的化合物的电子式为 ,这种化合物形成的晶体中所含的化学键类型有 。
(3)A2B的沸点高于A2D,其原因是 。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是 (用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总反应方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com