
题目列表(包括答案和解析)
18、(2009届灌南县高三化学模拟试题12分)
(1) O>N>C 1s22s22p63s23p63d84s2
 (2)顺铂易溶于水,因为它是极性分子,易溶于极性溶剂。 (3)
4
(2)顺铂易溶于水,因为它是极性分子,易溶于极性溶剂。 (3)
4
(4)sp3
18、(2009届灌南县高三化学模拟试题12分)
分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为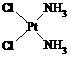 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为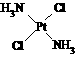 ,无抗癌作用。
,无抗癌作用。
(1) C、N、O三种元素的电负性由大到小的顺序是 ;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式: 。
(2)顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由: 。
(3)金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有 个铂原子。
(4)NH3还能与很多化合物通过配位键发生相互作用。N元素分别发生了 杂化;NH4+的结构式为 (必须标明配位键)。
17、(2009盐城市一中12分)
 (1)
(2分)
(1)
(2分)
(2)6(1分) (1分)
(3)分子晶体 (1分) CN -、C22-(任写一个)(2分)
(4)A (2分) (5) MgCNi3 (2分) 12 (1分)
17、(2009盐城市一中12分)不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀。
(1)基态碳(C)原子的轨道表示式为 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为 ;已知CrO5中Cr为+6价,则CrO5的结构式为 。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。
423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 ,与Ni(CO)4中配体互为等电子的离子是 
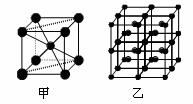
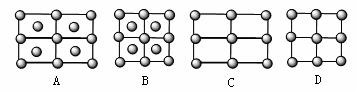
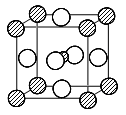
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到A~B图中正确的是 。
(5)据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有 个。
|
16、(通州市2009届高三12分)
(1)1s22s22p63s23p63d104s24p1 (2分) (2)ACD (2分)
(3)非极性分子(2分) 三角锥 (2分) sp2 (2分)
(4)NH3分子间能形成氢键,而AsH3分子间不能形成氢键 (2分)
16、(通州市2009届高三12分)第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似。 用砷化镓制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管照明,是节能减排的有效举措。试回答:
(1)Ga的基态原子的核外电子排布式为 。
(2)下列说法正确的是 (选填序号)。
A.砷和镓都属于p区元素 B.第一电离能:Ga>As
C.电负性:As>Ga D.半导体GaP、SiC与砷化镓互为等电子体
(3)砷化镓是由(CH3)3Ga和AsH3在一定条件下制备得到,同时得到另一物质,该分子是
(填“极性分子”或“非极性分子”)。AsH3的空间形状为
,(CH3)3Ga中镓原子的杂化方式为

(4)AsH3的沸点比NH3的低,其原因是 。
15、(南京市2009届高三化学12分)
(1)1s22s22p63s23p4(2分) (2)高(1分) 因为A的氢化物存在氢键(1分)
(3) 低(1分) CO2是分子晶体,SiO2是原子晶体(1分)
(4)[Cu(NH3)4]SO4(1分) 中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合(2分) (5)①③④(1分) 3 (1分) 2(1分)
15、(南京市2009届高三化学12分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况
。
 (5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
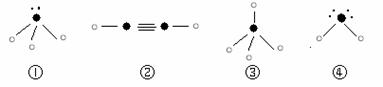
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
14、(1)S、F(各1分) (2)V型,直线型,SO2,(各1分)
CO2 是非极性分子,SO2 和H2O是极性分子,根据“相似相溶”原理,SO2 在H2O中的溶解度大。(2分) (3)Fe (1分) 第四周期第Ⅷ族(2分) 1s22s22p63s23p63d5(2分)
14、X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数比Y的核电荷数多20,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、E的元素符号依次为 、 ;
(2)XZ2分子的构型是 ,YZ2分子的结构是 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是
;
(3)Q的元素符号是 ,它在周期表中的位置 ,Q3+的核外电子排布式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com