
题目列表(包括答案和解析)
7.(14分)
(1)Al(OH)3 + OH- = AlO2-
+ 2 H2O(3分);2 NaCl(熔融)  2 Na + Cl2↑(3分);
2 Na + Cl2↑(3分);
(2)CaC2 + 2 H2O → C2H2↑+ Ca(OH)2(3分);
2 C2H2(g) +5 O2(g) = 4 CO2(g) + 2 H2O(l) ΔH= - 2600 kJ·mol-1(3分);Ca(HCO3)2(2分)
7.(14分)
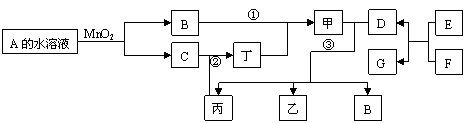
A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:

(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是 ;工业上冶炼A的化学反应方程式是 。
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是 ;1 mol C完全燃烧生成液态水时放热1300 kJ·mol-1,则C完全燃烧的热化学方程式是 。A与盐B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是 。
6. (16分)
(I)H-O-O-H(2分),铝热反应(2分),焊接铁轨、冶炼金属(2分);
(II)(1)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O(2分)
(2)6H2O +6e - =3H2↑+6OH - (2分)
(III)(3)②:2SO2+O2 2SO3(2分)
2SO3(2分)
③:2Fe+6H2SO4(浓)  Fe2(SO4)3+3SO2↑+6H2O(2分)
Fe2(SO4)3+3SO2↑+6H2O(2分)
(3)32g(2分)
6.(16分)已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。

(I)A的结构式 , E与F的反应是 (填反应名称),在工业生产中此反应有什么用途? 、 。
(II)若反应①除生成甲外,还生成丙,回答(1)、(2)小题:
(1)写出过量D与甲稀溶液反应的离子方程式:
(2)以D、F为电极,NaOH溶液为电解质溶液可以组成原电池,原电池正极的电极反应为:
(III)若A与丙可以化合生成甲;甲与D加热条件下可以生成三种化合物乙、丙、B,乙、丙、B常温下又可以反应生成甲和另一化合物X。
回答(2)、(3)小题:
(3)写出下列方程式 ②:
③:
(4)将含有1.2molX的水溶液调至中性,通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
5.(16分)(各2分)
(1)第四周期第Ⅷ族 (2)(NH4)2SO4·FeSO4·6H2O 蒸发浓缩、冷却结晶、抽滤
(3)①②④ (4)略
(5) 2NH4Cl+Ca(OH)2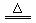 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(6)Fe2O3+2CO 2Fe+3CO2 (7)4Fe2++O2+4H+ =4 Fe3++2H2O
2Fe+3CO2 (7)4Fe2++O2+4H+ =4 Fe3++2H2O
(8) (8)3FeO(s) + 2Al(s)  Al2O3(s) +
3Fe(s) △H =-859.7KJ·mol-1
Al2O3(s) +
3Fe(s) △H =-859.7KJ·mol-1
5. (16分)下列16种物质之间有如下转化关系,部分产物已省略:
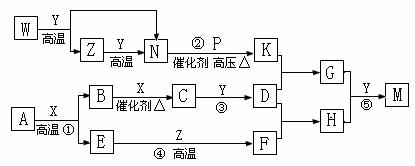
己知:(a) W、P、N、X、F是单质,其中F是金属单质,其它均是化合物。
(b) A是金黄色矿物。M是浅绿色的晶体。K与Y均是10电子分子。
(c)B与C两种化合物均由同主族的两种短周期元素组成。
(d)W元素的原子最外层电子数是次外层的两倍。
(e)反应②、③、④分别是工业制K、D、F的重要反应。反应⑤是实验室制M的重要反应。
请回答下列问题:
(1) 元素F在周期表中的位置是 ▲ 。
(2) 写出M的化学式 ▲ 。要从M的溶液中得到M晶体,其操作方法是 ▲ 。
(3)下列说法正确的是 ▲
①M是离子晶体。 ②稳定性:K<Y ③构成X、P、W、N的原子半径依次减小
④K气体易液化是由于液态K分子间存在氢键
(4) 仿照过氧化钠的电子式写出A的电子式 ▲ ,
(5) 写出实验室制K的化学方程式: ▲
(6) 写出反应④的化学方程式 ▲
(7) H的酸性溶液在空气中很容易变质,写出其变质过程的离子方程式: ▲ 。
(8己知
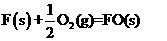 △H=-272.0KJ·mol-1
△H=-272.0KJ·mol-1
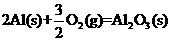 △H=-1675.7KJ·mol-1
△H=-1675.7KJ·mol-1
写出Al的单质和FO反应的热化学方程式 ▲ 。
4.(14分)
(1) Cl2+2OH-==Cl-+ClO-+H2O
(2)S(s)+O2(g)==SO2(g);△H=-296KJ/mol
(3)1
K2S 、 S2-+H2O HS-+OH- ,c(K+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
HS-+OH- ,c(K+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
2 5SO32-+2MnO4-+6H+==5SO42-+2Mn2++3H2O
(4) 2Cl-+2H2O==Cl2↑+H2↑+2OH- (每空2分)
4.(14分)短周期元素组成的单质X2、Y ,标准状况下X2的密度为3.17g·L-1,;常温下, Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol·L-1 Z的水溶液pH=13 。X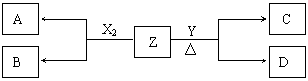 2、Y 和Z之间有如下转化关系(其他无关物质已略去):
2、Y 和Z之间有如下转化关系(其他无关物质已略去):
 (1)写出单质X2与Z反应的离子方程式:
(1)写出单质X2与Z反应的离子方程式:
(2)已知16g单质Y完全燃烧放出148kJ热量。写出热化学方程式:
(3)已知C能与硫酸反应生成能使品红溶液褪色的气体
①D的化学式是: ;D的水溶液pH>7,原因是(用离子方程式表示):
;D的水溶液中离子浓度大小顺序为
②将20mL 0.5mol·L-1 C溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。写出反应的离子方程式:
(4)石墨和铁做电极,用隔膜电解槽电解A的溶液,阳极产生X2 。
写出电解A溶液的离子方程式:
3.(本题14分)
(1) ②⑤ (2分)
(2) 4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+ (2分)
2Fe3++SO2+2 H2O =2Fe2++SO42-+4 H+ (2分)
(3)Fe3++3 H2O Fe(OH)3+3 H+
(2分)
Fe(OH)3+3 H+
(2分)
(4)MnO2 + 4 HCl(浓) Mn Cl2+Cl2↑+2
H2O
(2分)
Mn Cl2+Cl2↑+2
H2O
(2分)
|
实验步骤 |
实验现象 |
用化学用语解释 |
|
|
蓝(1分) |
Cl2+ 2I-=
I2+2Cl-(1分) |
|
|
|
5Cl2+ I2+6H2O=
2HIO3+10 HCl(2分) |
3.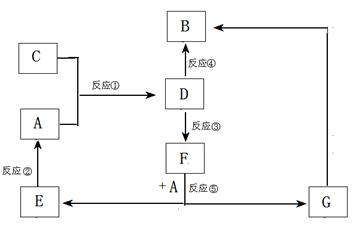 (14分)、A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。
(14分)、A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。
已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是 (填序号)。
(2)G生成B有多种途径。若在G的溶液中加入与G等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
反应③(即D将某种氧化物氧化为F)的离子方程式
(3)D的水溶液显酸性,请用离子方程式解释原因
(4)实验室制取C的化学方程式为
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
|
实验步骤 |
实验现象 |
用化学用语解释 |
|
将少量气体通入淀粉KI溶液 |
溶液最初变成 色 |
(用离子方程式表示) |
|
继续通入气体 |
溶液逐渐变成无色 |
(用化学方程式表示) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com