
题目列表(包括答案和解析)
15、
 凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
① 样品处理:准确称取奶粉试样1.000 g置于烧瓶中,加入足量不含氮元素的试剂A,一定条件下充分反应,产物用水溶解并冷却后全部转移至100 mL容量瓶中定容。
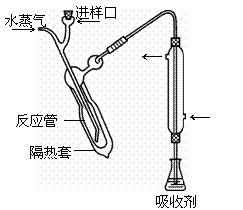
② 碱化蒸馏:量取容量瓶中溶液10.00 mL转移至右图所示的反应管中,再加入足量NaOH溶液,塞好进样口橡皮塞。通入高温水蒸气。用吸收剂吸收产生的气体。
③ 滴定:向吸收气体后的溶液中滴加2滴指示剂,用0.01 mol/LHCl标准溶液滴定至终点。
已知:
吸收剂中发生的反应为:NH3+4H3BO3=NH4HB4O7+5H2O;
滴定时发生的反应为:NH4HB4O7+HCl+5H2O=NH4Cl+4H3BO3。
根据以上知识回答下列问题:
⑴ 样品处理的目的是 ;通入高温水蒸汽的作用除加热外,还有 。
⑵ 冷凝管的作用是冷凝、导气、 。
⑶ 若蛋白质中氮元素的平均含量为16.0%,滴定终点时消耗盐酸标准液15.50 mL,则该奶粉中蛋白质的含量为 %。
⑷ 凯氏定氮法测定奶粉中蛋白质含量灵敏度高,操作简单,缺点是 。
四,本题包括2小题。
14.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL 同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |
则下列说法正确的是( )
A.甲组和乙组的实验中,盐酸均是过量的
B.盐酸的物质的量浓度为0.8 mol·L―1
C.合金中镁铝的物质的量之比为1∶1
D.丙组中铝的物质的量为0.009 mol
13.关于下列四个图像的说法中正确的是 ( )
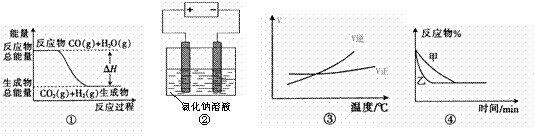
A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH小于0
CO2(g)+H2(g)”中的ΔH小于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1︰1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH小于0
2AB3(g)”的ΔH小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
12.2008年诺贝尔化学奖表彰了发现和研究绿色荧光蛋白质(GFP)的科学家。据研究报道:GFP在厌氧条件下不能发射荧光,而增加氧分子会渐渐开始发光。生色团是GFP发出荧光的物质基础,如下图所式的结构形成了GFP生色团的核心。
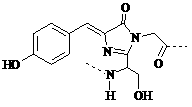
下列有关GFP的说法正确的是( )
A.遇强还原剂Na2SO3 或FeSO4时,GFP会发射更强荧光
B.该生色团的肽链结构中含有甘氨酸单元
C.该生色团结构中没有手性碳原子
D.温度超过70℃时,GFP因变性其荧光会消失
11.下列溶液中有关物质的量浓度关系正确的是 ( )
A.10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(OH-)相等
B.25℃时pH=10的NaOH溶液与pH=10的氨水中: c(Na+)=c(NH4+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:
c(NH4+)+c(Fe2+)+c(NH3·H2O)=0.3 mol·L-1
10.氯乙酸C1CH2COOH的酸性强于CH3COOH,这是因为C1是一种强吸电子基团,能使-OH上的H原子具有更大的活动性,有的基团属于斥电子基团,能减弱-OH上的H原子的活动性,这些作用统称为“诱导效应”,请根据以上规律对下列说法作出判断,其中错误的说法是 ( )
A.已知-C6H5属于吸电子基团,故C6H5COOH的酸性比CH3COOH强
B.CH3COOH的酸性弱于HCOOH,是由于CH3COOH分子存在斥电子基团甲基的缘故
C.HCOOH显酸性,而H2O显中性,是由于HCOOH分子中存在吸电子基团羧基的缘故
D.下列酸中:CF3COOH、CC13COOH、CHC12COOH,酸性最强的是CF3COOH
9.下列关于物质分离和提纯的方法正确的是( )
A.CuCl2酸性溶液中含有少量FeCl3:加入Cu(OH)2调节溶液pH=4,再过滤
B.苯中含有少量苯酚:加入浓溴水后过滤
C.CaCO3中混有少量CaSO4:加入饱和Na2CO3溶液,充分搅拌后过滤,再用水多次洗涤沉淀
D.乙酸乙酯中混有少量乙酸:加入NaOH溶液后萃取
8.在一定质量的硫酸溶液中加入氯化钡溶液直到反应完全,产生沉淀的质量与原硫酸溶液的质量相等,则原硫酸溶液中H2SO4的质量分数为( )
A.42% B.36% C.30% D. 24%
7.有W n+、X m+、Y m-、Zn-四种离子(m>n),且W、X、Y、Z四种原子的M电子层中的电子数均为奇数。下列说法中正确的是( )
A.W n+、X m+、Y m-、Zn-的离子半径依次增大
B.Y、Z的气态氢化物的热稳定性:YHm>HnZ
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强
6.下列各项内容中,排列顺序正确的是( )
① 固体的热稳定性:Na2CO3>CaCO3>NaHCO3
② 相同物质的量浓度的下列溶液中NH4+ 的浓度:(NH4)2SO4>(NH4)2CO3>NH4Cl
③ 微粒半径:K+>S2->F
④ 给出质子的能力:CH3COOH>C2H5OH>H2O
⑤ 氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com