
题目列表(包括答案和解析)
7、 下列实验能达到预期目的的是 ( )
A.为减小配制溶液的误差,容量瓶必须洗净并烘干后才能使用
B.向溶液中滴入盐酸有无色无味气体产生,则证明溶液中有CO32-
C.含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2,充分反应后过滤可除去Ca(OH)2
D.把纯净的铁和锌用导线连接一起插入到经过酸化的3%的NaCl溶液中,往铁电极区滴入2滴KSCN,有红色出现
6、下列溶液中,各组离子一定能够大量共存的是( )
 A.无色溶液中:K+、H+、SO32-、MnO4-
A.无色溶液中:K+、H+、SO32-、MnO4-
B、常温下,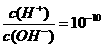 的溶液中:K’、Na+、CO32-、AlO2-
的溶液中:K’、Na+、CO32-、AlO2-
 C、能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
C、能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
 D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
4、NA代表阿伏加德罗常数,下列叙述错误的是( )
A.2mol乙醇和1mol乙二酸反应生成乙二酸二乙酯时,生成的水分子数为2NA
 B.3.2g N2H4中共用电子对的数目为0.5NA
B.3.2g N2H4中共用电子对的数目为0.5NA 
 C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.同温下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量不同
 5、中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容错误的是( )
5、中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容错误的是( )

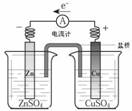

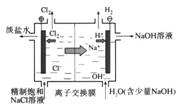

 A.铜锌原电池 B.中和热测定装置 C.离子交换膜法电解原理 D.氨的制取装置
A.铜锌原电池 B.中和热测定装置 C.离子交换膜法电解原理 D.氨的制取装置
 1、下列有关描述中不正确的是( )
1、下列有关描述中不正确的是( )
 A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性
A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性
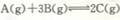
 B反应达平衡后,温度不变,增大压强,平衡正向移动但平衡
B反应达平衡后,温度不变,增大压强,平衡正向移动但平衡
 常数K不变
常数K不变
 C在KI溶液中加入氯化银固体,一段时间后沉淀变成黄色,说明同温度下KSP(AgI)<
C在KI溶液中加入氯化银固体,一段时间后沉淀变成黄色,说明同温度下KSP(AgI)<
 KSP(AgCl)
KSP(AgCl)
 D常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0
D常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0
2、下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( )
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③


 3、镁及其化合物一般无毒、无污染,且镁电池放电时电压高而平稳,使镁成为人们研制绿色电池的焦点之一。某种镁电池的工作原理为,有关该电池放电时的下列说法中错误的是( )
3、镁及其化合物一般无毒、无污染,且镁电池放电时电压高而平稳,使镁成为人们研制绿色电池的焦点之一。某种镁电池的工作原理为,有关该电池放电时的下列说法中错误的是( )
 A Mg2+向正极移动
A Mg2+向正极移动
 B正极反应为Mo3S4+2xe-
=====M03S42x-
B正极反应为Mo3S4+2xe-
=====M03S42x-
 C Mo3S4发生氧化反应
C Mo3S4发生氧化反应
 D负极反应为xMg一2xe- ====xMg2+
D负极反应为xMg一2xe- ====xMg2+
21、已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填高或低),理由是 。
(3)A的最高价氧化物对应的水化物分子中其中心原子采取 杂化,E的最高价氧化物分子的空间构型是 。
 (4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
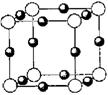
(5)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为 ;(每个球均表示1个原子)
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为 ,其晶体中所含的化学键类型为 。

20、化学在环境监测中越来越显示其重要作用,水体受还原性物质(主要是有机物)污染的程度常用化学需氧量(COD)来衡量。COD是指在一定条件下,用强氧化剂处理一定体积水样时所消耗的强氧化剂相当于氧气的质量,单位用mg/L表示。重铬酸钾法是指在强酸性溶液中,用一定量的重铬酸钾氧化(以Ag+作催化剂)水样中的还原性物质,本身被还原为Cr3+,过量的重铬酸钾以试剂亚铁灵作指示剂,用硫酸亚铁铵溶液回滴,根据相关试剂的用量即可求出水样的化学需氧量(COD)。
(1)当水样中含有浓度较高C1-时,常需加入HgS04溶液,HgS04作用及可能原因是: 。
(2)滴定时硫酸亚铁铵溶液需盛放在 (选填:“酸”或“碱”) 式滴定管中。
(3)国家《生活饮用水标准检验法》 (GB5750-85)中酚类的检测下限为0.002mg/L。某水源受化工厂污染,酚含量达0.282 mg/L,该污染的水样中酚(以苯酚氧化成C02计算)引起的化学需氧量(COD)为 mg/L。
(4)某化工园区有两家企业排放出的废水中,某次COD测量值高达2100mg/L,这两家企业最有可能是 。
a.制糖厂 b.水泥厂 c.电镀厂 d.造纸厂
(5)现有某废水样品10.OOmL,再加10mL蒸馏水,然后加入10.00mL0.04000mol/L K2Cr207溶液,3mLl%硫酸-硫酸银溶液,17mL硫酸汞溶液,加热反应2h。在试剂亚铁灵指示剂存在下用 0.1000mol/L Fe(NH4)2(S04)2溶液滴定多余的K2Cr207,共用去Fe(NH4)2(S04)2溶液12.00mL。试计算该水样的化学需氧量(COD)。

19、(1)相对分子质量不超过100的有机物X,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。X完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现X的氢谱如下:
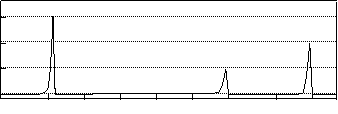
① X的分子中含有的官能团名称是__________________________________。
② X的结构简式为_____________ ______________________。

(2)请用合成反应流程图表示出由和其他无机物合成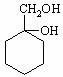 的方案:
的方案:
 提示:① 合成过程中无机试剂任选;
提示:① 合成过程中无机试剂任选;
② 合成反应流程图表示方法示例如下:
七,本题包括1小题.
18、水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)  CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
CO
(g) +H2 (g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
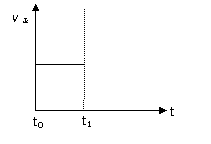 (3)上述反应在t0时刻达到平衡(如右下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
(3)上述反应在t0时刻达到平衡(如右下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
ν正、ν逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
ν正=ν逆 |
|
Ⅱ |
0.12 |
0.20 |
________ |
ν正=ν逆 |
|
Ⅲ |
0.10 |
0.20 |
0.40 |
ν正____ν逆 |
(5)己知:2C (s) + O2(g) = 2CO (g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ·mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ·mo1-1
若将24 g 炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为 kJ。
17、减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
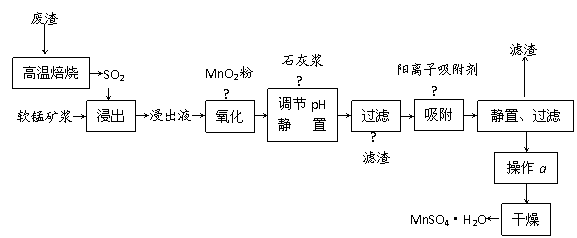
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
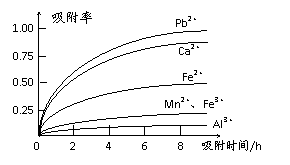
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
|
离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
74 |
7.6 |
9.7 |
|
Fe3+ |
64 |
2.7 |
3.7 |
|
Al3+ |
50 |
3.8 |
4.7 |
|
Mn2+ |
80 |
8.3 |
9.8 |
|
Pb2+ |
121 |
8.0 |
8.8 |
|
Ca2+ |
99 |
- |
- |
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,
氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是 (填写序号)。
a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 等过程。
五,本题包括1小题。
16、下图是由短周期元素组成的物质之间的转化关系。其中,A的相对分子质量为144,反应①中生成C、D物质的量之比为3 :1,D是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,F、G是气态非金属单质,K是一种常见的非极性有机溶剂,密度比水大。(某些生成物和反应条件已略去)
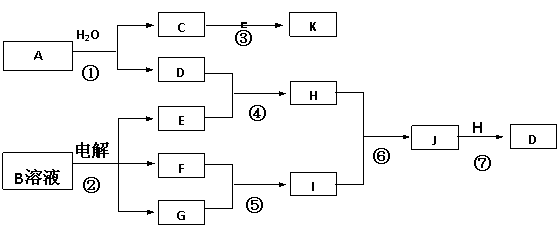

(1)A的化学式是 ;
(2)E中金属阳离子的检验方法 ;
(3)写出反应②的化学方程式 ;
(4)写出反应⑦的离子方程式:⑦ ;
(5)用离子方程式表示H溶液显碱性的原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com