
题目列表(包括答案和解析)
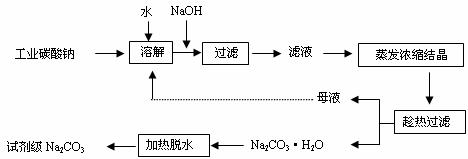
17、工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
 Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
32 36 t(℃)
Ⅱ、有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
 (1)加入NaOH溶液时发生的离子方程式为
。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
(1)加入NaOH溶液时发生的离子方程式为
。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
c(Mg2+):c(Fe3+)= 。
(2)“趁热过滤”时的温度应控制在 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行 ,并说明理由 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol-1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
五,本题包括1小题。
16、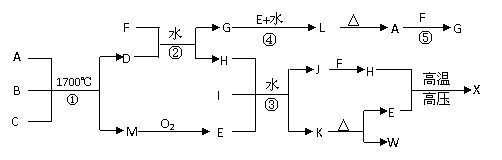 下图是部分短周期元素的单质和化合物之间的相互转化关系,部分反应中的生成物没有全部列出。A为两性化合物,B、C是常见的非金属单质,D是由两种元素组成的新型陶瓷,F、I、K、w的焰色反应均为黄色,且I是厨房中常用的调味品。x是人类最早合成的有机物。反应③是工业生产重要化工原料w的主要反应。
下图是部分短周期元素的单质和化合物之间的相互转化关系,部分反应中的生成物没有全部列出。A为两性化合物,B、C是常见的非金属单质,D是由两种元素组成的新型陶瓷,F、I、K、w的焰色反应均为黄色,且I是厨房中常用的调味品。x是人类最早合成的有机物。反应③是工业生产重要化工原料w的主要反应。
回答下列问题:
(1)写出x的分子式 。
(2)写出反应④的离子方程式:_ ;
(3)反应①是工业合成D的方法之一,反应①的化学方程式为 。
(4)工业生产中反应③的具体操作是:在I的饱和溶液中先通人H,再通人E。不先通 人E的原因是_________ 。
15、硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
指标 项目 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
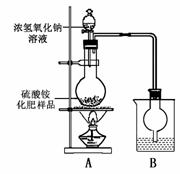 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
 [观察外观]
[观察外观]
 该硫酸铵化肥无可见机械杂质。
该硫酸铵化肥无可见机械杂质。
 [实验探究]
[实验探究]
 按右图所示装置进行实验。
按右图所示装置进行实验。
 (1)烧瓶内发生反应的离子方程式为:
(1)烧瓶内发生反应的离子方程式为:
 烧杯中盛放的试剂最好是
(填“浓硫酸”、“稀硫酸”或“水”)
烧杯中盛放的试剂最好是
(填“浓硫酸”、“稀硫酸”或“水”)
 (2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是

 [交流讨论]
[交流讨论]
 甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
 乙同学:实验装置中还存在另一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
 经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
 [探究结论]
[探究结论]
 称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。得出探究结论为
。
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。得出探究结论为
。
 四,本题包括2小题。
四,本题包括2小题。
14、某温度下,在一密闭容器中发生如下可逆反应:2E(g)  F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为O.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为O,当达到新的平衡时,下列说法正确的是
F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为O.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为O,当达到新的平衡时,下列说法正确的是
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若x=l,容器体积保持不变,新平衡下E的体积分数为50%
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度小于0.5a mol·L-1
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
13.今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出
a=b=0.1 mol/L
12.结构简式如右图所示的物质是药物多巴的主要成分。下列对该物质的描述不正确的是
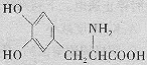 A.分别与氢氧化钠和盐酸反应,均生成盐
A.分别与氢氧化钠和盐酸反应,均生成盐
B.能发生加成、取代、缩聚、酯化等反应
C.1 mol该物质最多能和3 mol NaHCO3反应
D.该物质形成的蛋白质遇硝酸变黄色
11、 下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )
 A.图1:n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
A.图1:n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
 B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
 C.图3:n(HCl)=1mol时,K2CO3和HCl溶液在敞口容器反应生成的气体
C.图3:n(HCl)=1mol时,K2CO3和HCl溶液在敞口容器反应生成的气体
 D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)

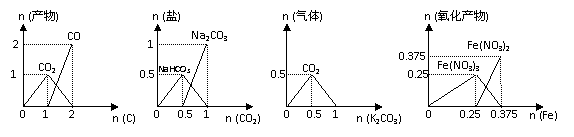







 图1
图2
图3 图4
图1
图2
图3 图4
10、有A、B、C三种短周期元素,最外层电子数之和为17,质子数之和为31。若C为Ar,则关于A、B两种元素的说法错误的是 ( )
( )
 A.如果A是金属元素,则B一定是稀有元素
A.如果A是金属元素,则B一定是稀有元素
B.如果A的单质通常情况下是气体,则B的单质通常情况下是固体
C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
D.如果A的最高正价是+3,则B的单质有两种常见的同素异形体
9、下列离子方程式书写正确的是( )
 A向氯化铝溶
A向氯化铝溶 液中加入过量氨水:A13++4NH3·H2O=====A102-+4NH4++2H2O
液中加入过量氨水:A13++4NH3·H2O=====A102-+4NH4++2H2O
 B甲醛与足量银氨溶液共热:
B甲醛与足量银氨溶液共热:



 C.用石墨电极电解硝酸银溶液:2Ag++2H20=====2Ag+O2↑十+4H+
C.用石墨电极电解硝酸银溶液:2Ag++2H20=====2Ag+O2↑十+4H+
 D.向碳酸氢钙溶液中滴加过量的烧碱溶液:
D.向碳酸氢钙溶液中滴加过量的烧碱溶液:
 Ca2++2HCO3-+2OH-=====CaC03↓+2H20十CO32-
Ca2++2HCO3-+2OH-=====CaC03↓+2H20十CO32-
8、盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)= 2CO2(g)+3H2O(g) △H3 = -Q3kJ·mol-1(Q3>0)
若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)( )
A.Q1+ Q2+Q3 B.0.5(Q1+Q2+Q3 )
C.0.5 Q1-1.5 Q2+0.5Q3 D.1.5 Q1-0.5 Q2+0.5Q3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com