
题目列表(包括答案和解析)
6. 甲、乙、丙是三种可溶于水且不含相同离子的离子化合物,它们含有的阳离子可能是NH4+、Ca2+、Mg2+、Na+,阴离子可能是NO3-、SO32-、OH-。取等质量的三种化合物配制成相同体积的溶液,其物质的量的浓度由大到小的顺序是甲>乙>丙,则乙物质是( )
A.NaOH B.Mg(NO3)2 C.(NH4)2SO3 D.NH4NO3
5.向5mLNaCl溶液里滴入一滴AgNO3溶液,出现白色沉淀,继续加入一滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为( )
A.KSP(AgCl)= KSP (AgI)= KSP (Ag2S) B.KSP (AgCl)<KSP (AgI)<KSP (Ag2S)
C.KSP (AgCl)>KSP (AgI)>KSP (Ag2S) D.因发生特殊反应,无法判断
4.下列表述中正确的是( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g) 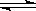 2SO3(g);△H=-QkJ·mol-1(Q>0),
2SO3(g);△H=-QkJ·mol-1(Q>0),
则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
C.在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+
D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者放出的热量多
3.下列有关热化学方程式的叙述中,正确的是( )
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中
和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l)
△H=十57.4 kJ/mol
B.已知C(石墨,s)=C(金刚石,s);△H> 0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g);△H=-483.6 kJ/mol,
则H2的燃烧热为 241.8 kJ/mol
D.已知 2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2 则△H1<△H2
2.化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题。下列实验问题处理方法正确的是( )
A.制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热
B.在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度
C.蒸发氯化钠溶液获取食盐时若有液滴飞溅,应立即向蒸发皿中加水冷却
D.给试管中的液体加热时,应不时移动试管或加入碎瓷片,以免暴沸伤人
1.我国的“嫦娥一号”月球探测卫星已成功发射并开始工作。据科学家预测,月球的土壤中吸附着数百万吨的 He,每百吨
He,每百吨 He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以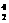 He的形式存在。下列说法正确的是( )
He的形式存在。下列说法正确的是( )
A.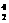 He原子核内含有4个质子
B.
He原子核内含有4个质子
B. He和
He和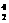 He互为同位素
He互为同位素
C. He原子核内含有3个中子
D.
He原子核内含有3个中子
D.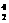 He具有较强的金属性
He具有较强的金属性
21、Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1 :2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);
(3)C分子中都包含_______个σ键,_______个π键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
______________________________________________________。
Ⅱ.CO的结构可表示为C≡O,N2的结构可表示为N≡N。
(5)下表是两者的键能数据:(单位:kJ/mol)
|
|
A-B |
A=B |
A≡B |
|
CO |
357.7 |
798.9 |
1071.9 |
|
N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:______________________________________________
__________________________________________________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 __ ____ ,基态Cu原子的价电子排布式为___________________________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型)。

20、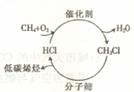 随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注。右图是最近研发出的天然气利用新途径:首先,甲烷在催化荆作用下发生“氧氯化反应”生成一氯甲烷;然后,一氯甲烷在400℃的条件下通过分子筛催化转化为低碳烯烃。
随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注。右图是最近研发出的天然气利用新途径:首先,甲烷在催化荆作用下发生“氧氯化反应”生成一氯甲烷;然后,一氯甲烷在400℃的条件下通过分子筛催化转化为低碳烯烃。
请根据以上信息回答下列问题:
(1) 第一轮次反应投料时甲烷和氯化氢的最佳体积比为 。
(2) 由一氯甲烷生成丙烯的化学方程式为 。
(3) 若该途径中的第一步“甲烷氧氯化反应”的转化率为80%,经除水、分离出混合物中的一氯甲烷后,剩余物质全部留用并投入第二轮次生产;第二步反应生成含有乙烯、丙烯、丁烯的混合气体,碳原子的利用率为90%,分离出其中的烯烃气体后剩余物质全部留用并投入第二轮次生产。则:
①标准状况下,1 m3甲烷经过一轮反应可得到 kg乙烯、丙烯、丁烯的混合气体。
②第二轮次反应投料时,需补充的甲烷、氧气和HCl的体积比为 。
19、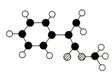 A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
(1)根据分子结构模型写出A的结构简式 ___________
(2)拟从芳香烃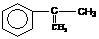 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。
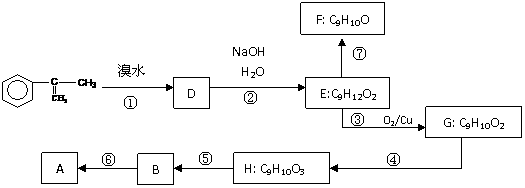


(a)写出⑤反应类型__________
(b)写出H的结构简式 ___________
(c)已知F分子中含有“-CH2OH”,通过F不能有效、顺利地获得B,其原因是 ________
__________________________________________________________________________
(d)写出反应方程式(注明必要的条件)
⑥ ________________________________________________________
⑦ __________________________________________________________
七,本题包括1小题.
18.工业合成氨与制备硝酸一般可连续生产,流程如下:
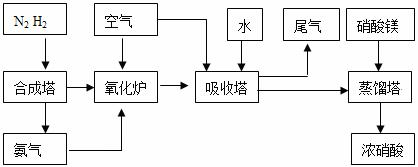
(1)某温度下体积为200L的氨合成塔中,测得如下数据:
|
时间(h) 浓度(mol/L) |
0 |
1 |
2 |
3 |
4 |
|
N2 |
1.500 |
1.400 |
1.200 |
C1 |
C1 |
|
H2 |
4.500 |
4.200 |
3.600 |
C2 |
C2 |
|
NH3 |
0 |
0.200 |
0.600 |
C3 |
C3 |
根据表中数据计算0-2小时内N2的平均反应速率 mol·L-1·h-1
若起始时与平衡时的压强之比为a,则N2的转化率为 (用含a的代数式表示)
(2)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法(Science,2,Oct.1998, p98),在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 。
(3)已知:N2(g)+O2(g) =2NO(g); △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ; △H=-483.6kJ/mol
则N2(g)+3H2(g)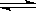 2NH3(g) 的 △H=_________________。
2NH3(g) 的 △H=_________________。
(4)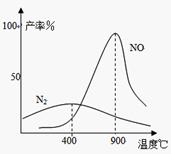 氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(5)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2请写出有关反应化学方程式
, 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com