
题目列表(包括答案和解析)
17. (10分)“关注民生”和“科学发展”是“十七大”报告的主
(10分)“关注民生”和“科学发展”是“十七大”报告的主
题之一,环境问题与“民生”和“科学发展”密切相关。世界
环保组织2006年度报告指出,在所有衡量地球健康状况的指标
中,人类仅成功地扭转了一项指标的恶化-大气中氯氟烃减少,
而C、S、N氧化物的排放有增无减,水资源的紧缺和污染加剧。
保证经济走可持续发展的道路,是化学工作者应尽的职责所在。
回答下列问题:
⑴ 大气中氯氟烃的减少带来的积极效果是 ;
⑵ 酸雨的化学特征是 。空气中硫氧化物和氮氧化物是形成酸雨的主要物质。若用NOx表示氮氧化物,请写出空气中氮氧化物形成酸雨的化学方程式 ;
⑶ SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:

① 在实验室测定模拟烟气中SO2的体积分数,现有注射器、洗气瓶、导管、量筒等仪器,
需要的药品有 ;
② 若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,已知气体流速,还
需测定的数据是 ;
⑷ 水体富营养化是导致水体藻类大量繁殖的主要因素。2007年春夏之交我省无锡太湖蓝
藻事件再次给水资源保护敲响警钟。检测显示,蓝藻爆发时太湖全湖N、P平均含量分别高达4.0和0.13 mg/L。环境专家建议用金属镁将水体中的NO3-还原为N2而消除污染,Mg则转变为Mg(OH)2沉降湖底。要使太湖水中N的平均含量下降至0.20 mg/L,则每立方米水体中应投入的镁粉应不少于 g。
五:(本题包括两大题,共20分)
16.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶
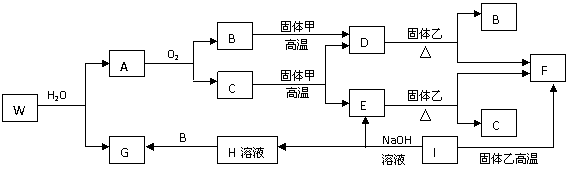 状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
 (1)B的电子式为
,固体乙的化学式可能是
;
(1)B的电子式为
,固体乙的化学式可能是
;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属
置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式____________________________________________,
I和NaOH溶液反应的离子方程式________________________________________。
15.(10分) “烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。“烂版液”的
主要成分是Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。
在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,至pH=8为止。
② 过滤后得到Zn(OH)2等沉淀,用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2……
⑴步骤①中控制溶液pH=8的操作是 ;步骤②中如何检验沉淀已经洗涤干净? 。
⑵步骤③中保持一定的pH、加热的目的是 ;趁热过滤的目的
是 。
⑶步骤④还缺少的操作是 ,所用的主要
仪器是 。
14.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是 ( )
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,Cu+只被氧化
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
第Ⅱ卷 非选择题(共72分)
13.根据下列有关图象,判断下列说法不正确的是 ( )

|


A.由图象Ⅰ可知,该反应在T1、T3处达到平衡,且该反应的△H<0
B.由图象Ⅱ可知,该反应在t5阶段NH3体积分数最大
C.图象Ⅲ是在10L容器中850℃时反应,由图可知到4min时,反应放出51.6kJ的热量
D.由图象Ⅳ可知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L
11.能正确表示下列反应离子方程式的是( )
A.过氧化钠固体与水反应:2O22-+2H2O == 4OH-+O2↑
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O=Cl-+SO42-+2H+
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
|
|
 LaNi5+6Ni(OH)2,下列说法正确的是(
)
LaNi5+6Ni(OH)2,下列说法正确的是(
)
A.放电时储氢合金作正极
B.放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
C.充电时阳极周围c(OH-)增大 D.充电时储氢合金作阴极
10.醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1mol/L醋酸钡溶液中粒子浓度关系不正确的是( )
A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)= c(CH3COO-) +c(OH-)
C. c(H+) = c(OH-)- c(CH3COOH)
D. 2c(Ba2+)= c(CH3COO-)+ c(CH3COOH)
合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选
项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就
为0分)
9. 阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A.100g98%的浓硫酸中含氧原子个数为4×6.02×1023
B.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
C.标准状况下,22.4LCH4和CH3Cl的混合物所含有的分子数目为6.02×1023
D.6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子数约为0.7×6.02×1023
8.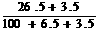
 某温度下100g饱和氯化钠溶液中含有26.5g氯化钠,若向此溶液中添加3.5g氯化
某温度下100g饱和氯化钠溶液中含有26.5g氯化钠,若向此溶液中添加3.5g氯化
钠和6.5g水,则所得溶液中溶质的质量分数为( )
A、30% B、26.5% C、 ×100% D、 ×100%
7. 从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳; ②在引入的海水中加入
石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体
氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第④步电解时阴极产生氯气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com