
题目列表(包括答案和解析)
4、下列说法正确的是 ( )
A、 F- 、Cl- 、Br- 、I- 随核电荷数的递增还原性增强,氧化性减弱
B、 Na2SiO3 俗称水玻璃,NaHCO3 俗称小苏打,Na2CO3 俗称苏打,Na2S2O3俗称大苏打
C、 进行铜丝在Cl2中燃烧的实验时,集气瓶中加少量水是不必要的操作
D、 浓硝酸和浓盐酸以物质的量的比1:3混合而成“王水”
3、下列说法不正确的是 ( )
A、丁达尔效应是胶体粒子对光线散射所形成的
B、制硅酸胶体时,若生成硅酸浓度较大时,则形成的是硅酸凝胶
C、 Fe(OH)3胶体带正电荷,向Fe(OH)3胶体中滴加稀盐酸,胶体先凝聚后又溶解
D、人工制造的分子筛主要成分是铝硅酸盐,主要用途是吸附剂和催化剂
2、焰色反应是 ( )
A、元素的性质 B、 原子的性质 C、离子的性质 D、是化学变化
1.查阅资料发现,金属钠不仅能跟氧气和水反应。还能跟多种其他物质发生反应,其中与酒精在常温下能反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列的研究方法中没有用到的是 ( )
A、 实验法 B、观察法 C、分类法 D、比较法
23.(10分)
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1) Ge的原子核外电子排布式为
(2) C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3) 按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式
;
②SiO2晶体的空间构型及硅氧之间的成键方式
;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4) CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(5) 碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A、强 B、弱 C、相等 D、无法判断
22.(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH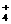 +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,l mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,l mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
⑴根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数__________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察__________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由__________色变成__________色。
⑵滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度(/mL) |
滴定后刻度(/mL) |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mo1·L-1,则该样品中氮的质量分数为__________。
21.(9分)
克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):

(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生加成反应生成

,其反应方程式为 (不要求标出反应条件)
(2)化合物I生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是 (填字母)
A、化合物Ⅱ可以与CH3COOH发生酯化反应
B、化合物Ⅱ不可以与金属钠生成氢气
C、化合物Ⅲ可以使溴的四氯化碳溶液褪色
D、化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为 (不要求标出反应条件)
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为 。
选做题(两题任选其中一题)
20.(9分)在2L的密闭容器中,加入2mol A和1mol B,发生下述反应:2A(g)+B(g)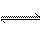 2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
⑴温度不变,若缩小容器的体积,则平衡_______移动(填正向、逆向或不)
⑵维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度
仍是0.4mol·L-1的是________。
A、4molA+2molB B、2molC+1molD
C、2molA+1molB+2molC+1molD D、1molA+0.5molB+1molC+0.5molD
⑶若维持容器的体积和温度不变,按不同配比加入起始物质,达到平衡时,C的浓度仍是0.4mol·L-1。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是________
②若加入0.2molA和0.1molB,则C和D起始物质的量分别
应满足________________,_____________
19.(15分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,并写出电极反应式:
正极 负极 。
(3)腐蚀印刷电路铜板后的混合液中,若Cu2+、Fe3+、Fe2+的浓度均为0.10mol/L,已知: Ksp[Fe(OH)3]=4.0×10-38。则溶液中Fe3+开始沉淀的PH值为 ;沉淀完全时的PH值 为 。请结合计算及表中数据和药品,简述除去CuCl2溶液中Fe3+、Fe2+的实验步骤 。
(已知:
lg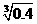 =-0.1
=-0.1  lg
lg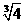 =0.2)
=0.2)
|
|
氢氧化物开始沉淀时的PH值 |
氢氧化物沉淀完全时的PH值 |
|
Fe3+ |
-- |
-- |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2 浓硫酸 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式:
。
劣质不锈钢腐蚀的实验现象: 。
18. (5分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
(5分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
|
化合物 |
甲 |
乙 |
丙 |
|
原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶2 |
⑴元素D在元素周期中的位置 。
⑵B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
⑶写出图I中沸点最高的单质与NaOH溶液反应的离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com