
题目列表(包括答案和解析)
4.(1)淀粉 溶液由蓝色变无色,且半分钟后颜色不再改变
(2)C
(3)分液漏斗,分液时上层液体应从上口出,下层液体应从下口出(或分液漏斗末端应紧靠烧杯内壁或打开上口活塞,使分液漏斗内外压强相等便于液体流下等。其他合理答案也给分);
(4)0.085mol/L
(5)961
4.测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I- I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用___________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是____________(填字母)。
A.方案可行。能准确测定溶液中的c(I2) B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
 Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即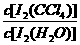 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。
回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是________(填名称)。
试指出该操作中应注意的事项为 。(任写一条)
(4)下层液体中碘单质的物质的量浓度是________________。
(5)实验测得上层溶液中c(I3-)=0.049
mol·L-1,结合上述有关数据,计算室温条件下反应I2+I- I3-的平衡常数K=____________________(用具体数据列出计算式即可)。)
I3-的平衡常数K=____________________(用具体数据列出计算式即可)。)
3.(15分)
(1)CO2+CO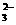 +H2O==2HCO
+H2O==2HCO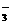 (3分)
(3分)
(2)K2CO3 (2分)
(3) (2分)
(2分)
(4)使原料有较大的转化率;(2分)
CO2原料易得等(2分)(其它合理答案均可给分)
(5)①减小 (2分) ②有利 (2分)
3.由碳的氧化物直接合成乙醇燃料已进人大规模生产。下图是由二氧化碳合成乙醇的技术
流程:
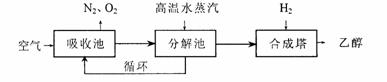
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通人高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇。
回答下列问题:
(1)写出吸收池中反应的离子方程式 。
(2)从分解池中循环使用的物质是 。
(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
 2CO(g)+4H2 CH3CH2OH(g)+H2O(g)
2CO(g)+4H2 CH3CH2OH(g)+H2O(g)
请写出该反应的化学平衡常数表达式K= 。
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是 ,由CO2制取CH3CH2OH的优点是 。(写出一点即可)
(5)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:
 温度(K)
温度(K)CO2转化率(%) N(H2)/n(CO2) |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2 |
60 |
43 |
28 |
15 |
|
3 |
83 |
62 |
37 |
22 |
根据表中数据分析:
①温度升高,该反应的平衡常数K值 (选填“增大”、“减小”或“不变”)。
②提高氢碳比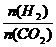 ,对生成乙醇 (选填“不利”、“有利’’或“无影响”)
,对生成乙醇 (选填“不利”、“有利’’或“无影响”)
2.(12分)
(1)abd ……………………………………………………………2分
(2)① …………………………………………2分
…………………………………………2分
②小 ………………………………………………………2分
(3)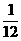 ……………………………………………………………3分
……………………………………………………………3分
(4)ac ……………………………………………………3分
2.(12分)
合成氨工业在现代农业、国防工业中,有着重要的地位
已知:N2(g) + 3H2(g)
 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
|
|
|
|
|
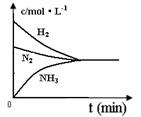
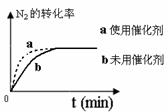
a. b. c.
1.(每空2分,共14分)
(1)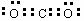 ;离子键和非极性共价键;2Na2O2+2CO2=2Na2CO3+O2[来源:高&考%资(源#网]
;离子键和非极性共价键;2Na2O2+2CO2=2Na2CO3+O2[来源:高&考%资(源#网]
(2)<;>
(3)强;SiO2-3+CO2+H2O=CO2-3+H2SiO3(胶体)
1.(14分)短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
|
元素 |
有关信息 |
|
X |
最外层电子数是次外层的2倍 |
|
Y |
元素主要化合价为-2价 |
|
Z |
其单质及化合物的焰色为黄色 |
|
M |
与X同主族,其单质为半导体材料 |
|
N |
其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 (1)XY2的电子式是
;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是
。
(1)XY2的电子式是
;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是
。
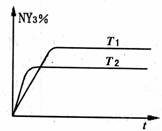
(2)恒容条件下,一定量的NY2、Y2发生反应:
2NY2(g)+Y2(g) 2NY3(g)。
2NY3(g)。
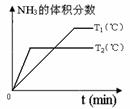
温度分别为T1和T2时,NY3的体积分数
随时间变化如右图,该反应的△H 0
(填“>”“<”或“=”,下同);若T1、T2
时刻反应的化学平衡常数分别为K1、K2,
则K1 K2。
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。
21.(8分)参照下表中物质的熔点,回答有关问题:
① 钠的卤化物及碱金属的氯化物的熔点高低取决于其______________________,
|
物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点℃ |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
|
物质 |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点℃ |
-90.2 |
-70.4 |
5.2 |
12.05 |
-70.4 |
-49.5 |
-36.2 |
-15.0 |
在这种情况下,____________越大,________________越弱,故熔点依次降低。
② 硅的卤化物及硅、锗、锡、铅的氯化物的熔点高低取决于其_______________,
___________________越大,___________________越大,故熔点依次升高。
③ 钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由于_______________
______________________________________________________________。
20.(10分)如图所示是某些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。
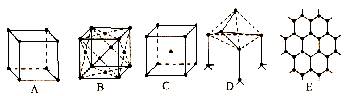
⑴ 其中代表金刚石的是(填编号字母,下同)______________,其中每个碳原子与______个碳原子最接近且距离相等。金刚石属于_________晶体。
⑵ 其中代表石墨的是_____________,其中每个正六边形占有的碳原子数平均为______个。
⑶ 其中代表NaCl的是___________。
⑷ 代表CsCl的是_____________,它属于___________晶体,每个Cs+与______个Cl-紧邻。
⑸ 代表干冰的是_________,它属于______晶体,每个CO2分子与______个CO2分子紧邻。
⑹ 上述五种物质熔点由高到低的顺序是_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com