
题目列表(包括答案和解析)
10.(12分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂其生产工艺如下:
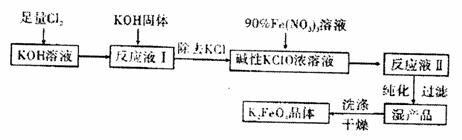
已知:①2KOH+Cl2 KCl+KClO+H2O(条件:温度较低)
②6 KOH+3 Cl2 5KCl+KClO3+3H2O(条件:温度较高)
 ③Fe(NO3)3 +KClO+KOH K2FeO4+KNO3+KCl+H2O
③Fe(NO3)3 +KClO+KOH K2FeO4+KNO3+KCl+H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行。(2)配平得到“反应液Ⅱ”的化学反应方程式:
 □Fe(NO3)3 +□KClO+□KOH □K2FeO4+□KNO3+□KCl+□H2O
□Fe(NO3)3 +□KClO+□KOH □K2FeO4+□KNO3+□KCl+□H2O
(3)在“反应液Ⅰ”中加KOH固体的主要目的是 。
A.与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为KClO
(4)若从“反应液Ⅱ”中分离出m g K2FeO4,则理论上至少消耗氯气V L(换算为标准
状况)。
V= L(用含字母m的算式表示)。
(5)将适量K2FeO4晶体分别溶解于pH为4.74、7.00、11.50的水溶液中,配制FeO42-
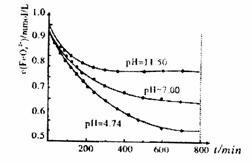 浓度均为1.0×10-3mol·L-1的试样,分别静 置800min至FeO42-浓度不再改变,结
浓度均为1.0×10-3mol·L-1的试样,分别静 置800min至FeO42-浓度不再改变,结
果见右图。已知高铁酸钾在水中的反应为:
 FeO42-+10 H2O 4 Fe(OH)3+8OH
FeO42-+10 H2O 4 Fe(OH)3+8OH
+3O2↑。发现初始pH=11.50的溶液中, 800min时高铁酸钾的最终浓度比pH=4.74的溶液中高,主要原因是: 。
9.(1)① c (1分) ② n/3 (2分);K=25/12或2.08 (2分) ③ 低于 (1分)
(2)N2 (1分) 氨气氧化生成NO的反应为放热反应,升高温度转化率下降 (2分)
(3)H2+CO32--2e- = CO2↑+ H2O (2分)阳极:N2O4+2HNO3-2e- = 2N2O5+2H+ (2分)
9.(13分)
(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n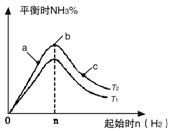 表示物质的量):
表示物质的量):
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
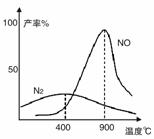 4NH3+5O2
4NH3+5O2 4NO+6H2O
4NO+6H2O
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是__________。
(3)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
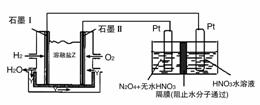
写出石墨Ⅰ电极上发生反应的电极反应式:__________。
在电解池中生成N2O5的电极反应式为:__________。
8.(12分)
(1)>(2分) (2)50%(2分) (3)A、C(2分)
(4) 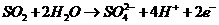 (3分)
(5)40(3分)
(3分)
(5)40(3分)
8.(12分)利用催化氧化反应将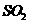 转化为
转化为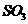 是工业上生产硫酸的关键步骤。
是工业上生产硫酸的关键步骤。
 已知:
已知: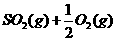
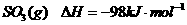 。
。
(1)在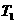 温度时,该反应的平衡常数
温度时,该反应的平衡常数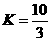 ,若在此温度下,向
,若在此温度下,向 的恒容密闭容器中,充入
的恒容密闭容器中,充入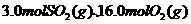 和
和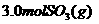 ,则反应开始时正反应速率
逆反应速率(填“<”、“>”或“=”)。
,则反应开始时正反应速率
逆反应速率(填“<”、“>”或“=”)。
(2)在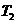 温度时,开始在
温度时,开始在 的密闭容器中加入
的密闭容器中加入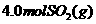 和
和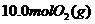 ,一定条件下当反应达到平衡时共放出热量
,一定条件下当反应达到平衡时共放出热量 。此时二氧化硫的转化率为
。
。此时二氧化硫的转化率为
。
(3)在(2)中的反应达到平衡后,改变下列条件,能使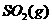 平衡浓度比原来减小的是
平衡浓度比原来减小的是
(填字母)。
 A.保持温度和容器体积不变,充入
A.保持温度和容器体积不变,充入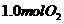
B.保持温度和容器内压强不变,充入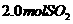 和
和
C.降低温度
D.在其他条件不变时,减小容器的容积
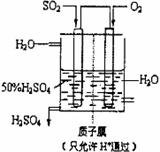
(4)有人设想以右图所示装置用电化学原理生产硫酸,写出通入
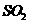 的电极的电极反应式:
。
的电极的电极反应式:
。
(5)由硫酸可制得硫酸盐。在一定温度下,向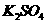 溶液中滴加
溶液中滴加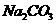 溶液和
溶液和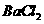 溶液,当两种沉淀共存时,
溶液,当两种沉淀共存时,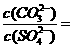 。[已知该温度时,
。[已知该温度时,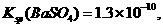
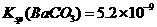 ]
]
7、(12分)
(1)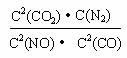 (2分)
(2分)
(2)1.88×10-4mol/(L·s) (2分)
(3)< (2分)
(4)C、D (2分)
(5)Ⅱ 280 1.2×10-3 5.80×10-3 (2分)
Ⅲ 1.2×10-3 5.80×10-3 (2分)
7.(12分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO  2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/ mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/ mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K= 。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在上述条件下反应能够自发进行,则反应的 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据。
|
实验编号 |
T/℃ |
NO初始浓度 mol·L-1 |
CO初始浓度 mol·L-1 |
催化剂的比表面积 ㎡·g-1 |
|
Ⅰ |
280 |
1.2×10-3 |
5.8×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
6.(12分)
(1)Fe-2e-=Fe2+ Cr2O72-+6 Fe2++14H+=6 Fe3++2 Cr3++7 H2O(各2分)
(2)2 CrO42-+2 H+  Cr2O72-+ H2O (2分) 5.0×105;(2分)
Cr2O72-+ H2O (2分) 5.0×105;(2分)
(3)AgCl (1分) 加入最后一滴AgNO3溶液出现砖红色沉淀(1分)
由于存在2
CrO42-+2 H+  Cr2O72-+
H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP,c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大。(2分)
Cr2O72-+
H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP,c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大。(2分)
6.(12分)铬元素在溶液中主要以Cr3+、Cr2O72-、CrO42-离子存在,在日常生活和生产中有不同的用途,但使用不当也会产生危害。请运用化学反应原理解决下列与铬有关的问题。
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的PH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ▲ ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: ▲ 。
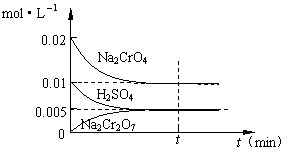 (2)在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,在此转化过程中,各物质浓度变化如右图所示:
(2)在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,在此转化过程中,各物质浓度变化如右图所示:
根据实验现象写出该平衡转化的离子方程式:
▲ 。
请根椐图中数据计算该反应的平衡常数 ▲ 。
(3)Ag2CrO4为砖红色沉淀,以2~3滴K2CrO4为指示剂,用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。Ag2CrO4、AgCl的KSP分别为9.0×10-12和1.56×10-10。滴定过程中首先析出沉淀为 ▲ ,达到滴定终点的实验现象是 ▲ 。
该沉淀滴定要控制K2CrO4的浓度和溶液的PH值,其PH范围应在6.5~10.5,若PH<6.5实验结果偏高。请用平衡移动原理分析为什么结果会偏高。 ▲ 。
5.(18分)恒温、恒压下,在一个可变容积的容器中发生如下反应:
A(气)+B(气)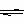 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为_______________mol.
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为______mol。
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=________mol,y=________mol。平衡时,B的物质的量____________(选填一个编号)
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol
作出此判断的理由是__________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是_________________。
II 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较__________(选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是_______________________________。
5:(18分)I (1)(1-a)mol
(2)3amol。
(3)平衡时C的物质的量与(2)中C的物质的量相同,说明(3)与(2)的平衡为同一平衡,则(3)x=2 ; y=(3-3a)mol ;丁;
如果放入A、B、C三物质后,平衡不移动,C的物质的量不变,那么3a=1mol时,B的量为(3-3a)mol=2mol;平衡向右移动时,3a>1mol,B里应小于2mol,平衡向左移动时,3a<1mol,B里应大于2mol。(4)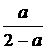
(5)乙
A(气)+B(气)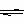 C(气)是一个体积缩小的反应,因此(5)中相当于在(1)的基础上减小压力,平衡逆向移动,所以a>b。
C(气)是一个体积缩小的反应,因此(5)中相当于在(1)的基础上减小压力,平衡逆向移动,所以a>b。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com