
题目列表(包括答案和解析)
19、(山东省潍坊市2010届高三教学质量抽样检测C,5)核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象 ( )
A.18O 31P B.19F 12C
C.元素周期表中IIIA族所有元素的原子 D.元素周期表中第三周期元素的所有原子
18、(福建省上杭一中、武平一中、长汀一中2010届高三上学期期末联考,9)已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
A. 该反应显示硫酸具有酸性
B. NH4CuSO3中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 反应中硫酸作氧化剂
高频考点七 原子结构 元素周期律与化学键
17、(浙江省绍兴一中2009-2010学年第一学期高三期末调测,15)Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是 ( )
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
16、(安徽省合肥市2010年高三第一次教学质量检测,8)甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
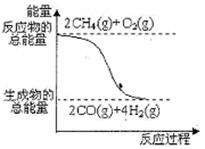 ①2CH4(g)+O2(g)=2CO(g)+4H2(g); △H=-71kJ·mol-1
①2CH4(g)+O2(g)=2CO(g)+4H2(g); △H=-71kJ·mol-1
②CO(g)+2H2(g)=CH3OH(l) ; △H=-90.5kJ·mol-1
下列描述错误的是( )
A.CO(g)+2H2(g)==CH3OH(g)
△H>-90.5kJ·mol-1
B.在甲醇燃料电池中,甲醇所在电极为正极
C.CH4(g)+1/2o2(g)===CH3(OH)(l)
△H=-126kJ·mol-1
D.反应①中的能量变化如右图所示
高频考点六 氧化还原反应
15、(2009~2010学年度大连市第二十四中学高三第二次考试题,10)已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol 下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
14、(银川一中2010届高三年级第六次月考,11)盖斯定律认为能量总是守恒的,化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)=H2O(1);△H1=-Q1 kJ•mol-1 ②C2H5OH(g)=C2H2OH(1);△H2=-Q2 kJ•mol-1 ③C2H2OH(g)+3O2(g)=2CO2(g)+3H2O(g); △H3=-Q3 kJ•mol-1 ,若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(kJ) ( )
A.Q1+Q2+Q3 B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3 D.0.5(Q1+Q2+Q3)
13、(福建省上杭一中、武平一中、长汀一中2010届高三上学期期末联考,4)设阿伏加德罗常数为NA。则下列说法正确的是
A. 常温常压下,6 g  所含有的中子数目为2NA
所含有的中子数目为2NA
B. 标准状况下,0.3 mol二氧化硫中含有氧原子数为0.3NA
C. 常温下,2.7 g铝与足量的盐酸反应,失去的电子数为0.3NA
D. 常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.2NA
高频考点五 化学反应与能量变化
12、(福建省福州市2010届高三上学期化学测试模拟卷,5)设nA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是 ( )
A.1 mol 硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3nA 个氢原子
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA个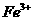
11、(浙江省绍兴一中2009-2010学年第一学期高三期末调测,6)设NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.71 g氯气被还原得到的电子数为2NA
B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C.标准状况下,2.24 L苯中含有的碳原子数为0.6 NA
D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA
10、(安徽省合肥市2010年高三第一次教学质量检测,7)在下列给定条件的溶液中,一定能大量共存的离子组是 ( )
A.无色溶液:Ca2+、H+、Cl-、HSO-3
B.强酸性溶液中:Al3+、Fe2+、ClO-、SO2-4
C.c(OH-)=0.1mol·L-1的溶液:Na+、K+、SiO2-3、NO-3
D.含有0.1mol·L-1Ca2+的溶液:Na+、K+、Cl2-3、Cl-
高频考点四 化学中常用计量及其计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com