
题目列表(包括答案和解析)
59、(江苏省江浦高级中学2010届高三模块复习,16)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
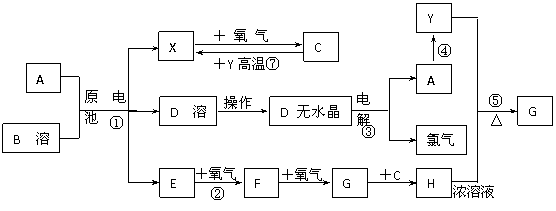
请填写下列空白:
⑴反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
________________________ 。
⑵从D溶液制备D的无水晶体的“操作a”为 ________________________ 。
⑶反应②的化学方程式为 ________________________ 。
⑷反应⑤的化学方程式为 ________________________ 。
⑸原电池反应①中正极的电极反应式为 ________________________
.(1)2Mg+CO2===2MgO+C; (2分) (2)将D溶液在HCl气流中蒸干;(2分)
(3)②4NH3+5O2  4NO+6H2O; (2分)
4NO+6H2O; (2分)
(4)⑤C+4HNO3(浓) CO2↑+4NO2↑+2H2O (2分)
CO2↑+4NO2↑+2H2O (2分)
(5)2NH4++2e- = 2NH3↑+H2↑ (2分)
高频考点二十一 化学实验题
58、(天津一中2010届高三上学期第三次月考 ,24)
,24)
 金属钛被称为铁和铝之后掘起的“第三金属”,常见化合价为+4,0,它是空间技术、航海、化工、医疗上不可缺少的材料,为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
金属钛被称为铁和铝之后掘起的“第三金属”,常见化合价为+4,0,它是空间技术、航海、化工、医疗上不可缺少的材料,为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
请回答下列问题:
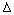 (1)钛铁矿经氧化法得到四氯化钛的化学反应为:
(1)钛铁矿经氧化法得到四氯化钛的化学反应为:
2FeTiO3 + 6C + 7Cl2 ==== 2FeCl3 + 2TiCl4 + 6CO,该反应中还原剂是____________,每生成1mol TiCl4 的过程中转移电子____________mol。
(2)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,试写出该反应的化学方程式_______________________________________________
(3)已知 ① Mg(s) + Cl2 (g)==== MgCl2(s) ΔH= -641 KJ/mol
② Ti(s) + 2Cl2 (g)==== TiCl4(l) ΔH= -770 KJ/mol
则Mg与TiCl4反应的热化学方程式为__________________________________________
该反应在氩气中进行的理由是________________________________________________
(4)氯碱厂电解饱和食盐水的离子方程式为________________________________________
将铝片和镁片用导线相连插入氢氧化钠稀溶液中构成原电池,写出负极的电极反应式
_____________________________________________________________________
(5)在上述产业链中,合成96t甲醇理论上需额外补充H2______________t(不考虑生产过程中物质的任何损失)
(1) C、FeTiO3 2分
7mol 2分
(2) TiCl4 + 3H2O === H2TiO3 + 4HCl 2分
(3) 2Mg(s) + TiCl4(l) === 2MgCl2 + Ti(s) ΔH= -- 512KJ/mol 2分
(4) Mg易被氧化(防止Mg被氧化) 2分
2Cl- + 2H2O 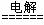 Cl2 ↑+ H2 ↑+ 2OH- 2分
Cl2 ↑+ H2 ↑+ 2OH- 2分
(5) 12 2分
57、(浙江温州市2010届五校第一学期期末联考,27)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)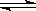 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K= ,升高温度,K值
(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(用 nB tB 表示)
 (3)在其他条件不变的情况下,
(3)在其他条件不变的情况下,
对处于E点的体系体积压缩到原来的
1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少
b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加
d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
 (5)使用燃料电池是节能减排的重要手段之一。CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气。电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO + 3H2 = CH3OCH3 + CO2
或 2CO+4H2 = CH3OCH3
+ H2O。
(5)使用燃料电池是节能减排的重要手段之一。CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气。电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO + 3H2 = CH3OCH3 + CO2
或 2CO+4H2 = CH3OCH3
+ H2O。
上述水煤气燃料电池的负极反应方程式:(写1个) 。
(6)右图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数。
根据该图写出二甲醚燃烧的热化学方程式:
(1)K=c(CH3OH)/c(CO)·c2(H2) (2分) 减小 (2分)
(2)2nB/3tBmol·(L·min)-1 (2分)
(3)b c (2分)
(4)Cu2O+CO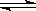 2Cu+CO2 (2分)
2Cu+CO2 (2分)
(5)CO+O2--2e-=CO2 H2+O2--2e-=2H2O (任写一个得满分) (2分)
(6)CH3OCH3(g)+3O2(g) 2CO2(g)+3H2O(l) △H=-1455kJ·mol-
1 (2分)
2CO2(g)+3H2O(l) △H=-1455kJ·mol-
1 (2分)
高频考点二十 无机推断题
56、 (福建省龙岩一中2009-2010学年度高三第七次月考,24)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
(福建省龙岩一中2009-2010学年度高三第七次月考,24)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 ②计算在80℃时该反应的平衡常数K= ;
③反应进行至l00s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号) ;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(2)①丙烷脱氢可得丙烯。
 已知:C3H8(g) CH4(g)+HC=CH(g)+H2(g);△H1=156.6 kJ·mol-1
已知:C3H8(g) CH4(g)+HC=CH(g)+H2(g);△H1=156.6 kJ·mol-1
 CH4(g)+HC=CH(g) CH3CH=CH2(g);△H2=-32.4
kJ·mol-1
CH4(g)+HC=CH(g) CH3CH=CH2(g);△H2=-32.4
kJ·mol-1
 则相同条件下,反应C3H8(g) CH3CH=CH2(g)+ H2(g)的△H= ;
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+ H2(g)的△H= ;
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池总反应方程式为 ;
③常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3) c(CO32-)(填“>”、“=”或“<”'),原因是 。(用文字说明)
(1)①0.0020mol/(L.s)②1.8
③变浅 ④D
(2)①124.2kJ.mol-1
②C3H8+5O2 3CO2+4H2O;③>;HCO3-的水解程度大于电离程度。
55、(2010年温州市高三第一次适应性测试,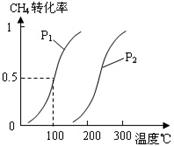 27)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
27)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为
100L),在一定条件下发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关
系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表
示的平均反应速率为_▲_。
②图中的P1_▲_P2(填“<”、“>”或“=”),100℃时平衡
常数为_▲_。
③在其它条件不变的情况下降低温度,逆反应速率将_▲_(填“增大”、“减小”或“不变”)。
(2)在压强为0.1
MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H_▲_0,△S_▲_0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_▲_。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了
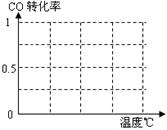 三组实验,部分实验条件已经填在下面实验设计表中。
三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
ⅰ |
150 |
1/3 |
0.1 |
|
ⅱ |
_▲_ |
_▲_ |
5 |
|
ⅲ |
350 |
_▲_ |
5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
(1)①0.0030mol·L-1·min-1(2分,单位1分) ②<(1分) 2.25×10-4(2分) ③减小(1分)
(2)④< <(各1分共2分) ⑤BD(2分)
 ⑥A(每空1分共3分)
B.(曲线1、压强 1共2分)
⑥A(每空1分共3分)
B.(曲线1、压强 1共2分)
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
ⅰ |
|
|
|
|
ⅱ |
150 |
1/3 |
|
|
ⅲ |
|
1/3 |
|
54、(北京市宣武区2010届上学期期末质量检测,18) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:

(3)某实验小组依据甲醇燃烧的反应原理,
设计如右图所示的电池装置。
该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的
pH减小,该电池总反应的化学方程式为
。
(1)① I ② < ③ 80% 250℃
(2) CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol
(3)① O2 + 2H2O + 4e- = 4OH-
② 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
高频考点十九 化学反应速率与化学平衡综合题
53、(山东省潍坊市2010届高三教学质量抽样检测C
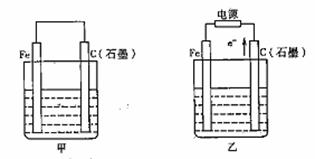 ,21)如图甲、乙是电化学实验装置。
,21)如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为 。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
(1)①O2+2H2O+4e-→4OH-
|
②2Cl-+2H2O====2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O=10HCl+2HIO3
(2)①Fe→Fe2++2e-
②CuO(或CuCO3) 0.8(或1.24)
52、(安徽师大附中2010届教学质量监测,23)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为 。
② 已知1 mol·L-1 100mL B的溶液能与1 mol·L-1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。
(1)H(1分)2)共价(1分)
|
(4)① NH4+ + OH- ===== H2O + NH3↑ (2分)
② SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ (2分)
(5)① (NH4)2Fe (SO4)2·6H2O (2分)
② 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O (2分)
高频考点十八 电化学综合题
51、(山东省济南市2010届高三年级第一次模拟考试,18)下列为元素周期表的一部分,表中阿拉伯数字(1、2……)是原周期表中行或列的序号。请参照元素A~I在表中的位置,回答下列问题。
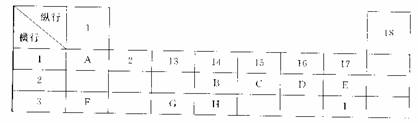
(1)B、C两元素中非金属性较强的是 (写出元素名称),请设计一个简单的实验证明这一结论 。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M。写出Z与Y反应的化学方程式: 。
 (4)I元素在周期表里的位置在第 周期、第 族。
(4)I元素在周期表里的位置在第 周期、第 族。
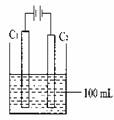
实验室中采用右图所示装置模拟工业上同时制取元素A和I
的单质过程:
①写出电极C1上发生反应的电极反应式 。
②当电极上产生112mL(标准状况)元素I单质气体时(假设
气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。
( )
)
(1)(3分)氮(1分),取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3===NaNO3+H2O+CO2↑
或2HNO3+Na2CO3===2NaNO3+H2O+CO2↑(2分)(可不写化学方程式,其他合理的答案也得分)
(2)(2分)Al2O3+2OH-+3H2O===2[Al(OH)4]-(2分)
(3)(2分)2Na2O2+2H2O===4NaOH+O2↑(2分)
(4)(6分)第三周期,VIIA族(2分);
①2Cl-→Cl2↑+2e-(分)
②13(2分)
50、(2009~2010学年度大连市第二十四中学高三第二次考试题,22)已知由短周期元素组成的A、B、C、D、E五种化合物,它们所含原子数目依次为2、3、4、5、6,其中A、B、C、E含有18个电子,D含有10个电子。请回答:
(1)A的化学式是: , 用电子式表示B的形成过程 。
(2)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,化学方程式是 。
(3)若C为第一和第二周期元素组成的化合物,在C的溶液中加入少量二氧化锰,有无色气体生成,则C分子中化学键的类型 和 。
(4)由第二周期元素形成的氢化物E和C都含有18电子, E是一种6原子分子,可做火箭发动机的燃料,C是一种常见强氧化剂。已知16g液态E与液态C充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ的热量。回答下列两个问题:
①请写出E的结构式
②写出E与C反应的热化学方程式:
(1)HCl ;略 ;(各1分,共2分)
(2)2PH3 + 4O2 = P2O5 + 3H2O (2分)
(3)2H2O2 = 2H2O + O2 ↑(1分) 极性键和非极性键 (2分)
(4)略 (1分) N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-1676 kJ•mol-1(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com