
题目列表(包括答案和解析)
3、放热反应和吸热反应:
放热反应:放出热量的化学反应,常见的反应有: 。
吸热反应:吸收热量的化学反应,常见的反应有: 。
2、判断化学反应是放出能量还是吸收能量的方法:
①从微观结构表现判断
断键吸收的能量 (大于、小于)成键放出的能量,反应吸收能量。
断键吸收的能量 (大于、小于)成键放出的能量,反应放出能量。
②从宏观表现去判断:
反应物具有的总能量(E反) (大于、小于)生成物具有的总能量(E生)时,反应放出能量;反应物具有的总能量(E反) (大于、小于)生成物具有的总能量(E生)时,反应吸收能量。
1、化学键与化学反应中能量变化的关系
化学反应中能量变化的主要原因:断开化学键要 (放出、吸收)能量,形成化学键要 (放出、吸收)能量。由于吸收和放出的能量不相等,故任何化学反应都伴随着能量的变化,一般表现为 的变化,有时也可表现为化学能与电能等的相互转化。
4、还原剂: (得、失)电子的反应物,有 (氧化性、还原性),在反应中被 (氧化、还原),元素化合价 (升高、降低)。
练习:举例说明四种基本类型反应与氧化还原反应的关系。
3、氧化剂: (得、失)电子的反应物,有 (氧化性、还原性),在反应中被 (氧化、还原),元素化合价 (升高、降低)。
2、特征:元素的 在反应前后发生变化。
1、本质:有电子 的反应。
10、可逆反应2SO2
+ O2 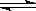 2SO3达到平衡的标志是:
2SO3达到平衡的标志是:
A.消耗2 mol SO2的同时生成2 mol SO3
B.SO2、O2与SO3的百分含量不再改变
C.反应混合物中,SO3的质量分数不再改变
D.反应混合物中各物质的物质的量不再改变
9、在N2 + 3H2
 2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则该反应的平均速率是
2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则该反应的平均速率是
A.v(H2) = 2.4 mol/(L·s) B.v(H2) = 1.6mol/(L·s)
C.v(N2)= 0.8 mol/(L·s) D.v(N2) =0.08 mol/(L·s)
8、下列说法正确的是
A.0.1mol/L盐酸和0.1mol/L硫酸与2mol/L氢氧化钠溶液反应速率相同
B、大理石与大理石粉分别与0.1mol/L盐酸反应速率相同
C、镁、铝在相同条件下分别与0.1mol/L盐酸反应,其反应速率不同
D、0.1mol/L盐酸和0.1mol/L硝酸与相同形状和大小的大理石反应,速率相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com