
题目列表(包括答案和解析)
4、当干冰熔化或气化时,下列各项中发生变化的是( )
A、分子内化学键 B、分子间距离
C、分子构型 D、分子间作用力
3、关于氢键,下列说法正确的是( )
A、每一个水分子内含有两个氢键
B、冰和水中都存在氢键
C、DNA中的碱基互补配对是通过氢键实现的
D、水是一种非常稳定的化合物,是由于氢键所致
2、共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436KJ/mol,是指1molH2分子变成2molH原子需要吸收436KJ的能量。你认为下列分子中的共价键能量最大的是( )
A、HF B、HCl C、HBr D、HI
1、能与氢原子形成含有最强极性键的原子是( )
A、F B、Cl C、I D、Br
22、判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强。含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
|
名称 |
次氯酸 |
磷酸 |
硫酸 |
高氯酸 |
|
结构式 |
Cl-OH |
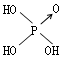 |
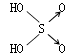 |
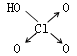 |
|
非羟基氧原子数 |
0 |
1 |
2 |
3 |
|
酸性 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸, H3AsO3既有弱酸性又有弱碱性。由此可推断它们的结构式分别为:①___________②____________
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是
①__________________②__________________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为:__________________。
21、PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小;另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构?
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体:__________________,
黄绿色固体:__________________。
⑶淡黄色固体物质是由____________分子组成,黄绿色固体物质是由________________分子组成(填“极性分子”或“非极性分子”)。
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是__________________。
20、水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)已知2H2O=H3O++OH-,H3O+的立体构型是______________________________,中心原子的杂化类型是__________________。
(2)在OH-、H2O、H3O+、H2O2中均含有的化学键是( )
A、极性键 B、非极性键 C、配位键
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为__________________。
(4)在20℃,1.01×105Pa,水可以结成冰,称为热冰。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是( )
A、金刚石 B、干冰 C、食盐 D、固态氮
19、下列表示分子结构的图示中,●表示短周期的几种元素的“原子实”[指原子除去最外电子层电子后剩余的部分,周围小黑点表示没有用于形成共价键的最外层电子,短线代表共价键。例如X2 (X代表卤素原子):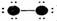
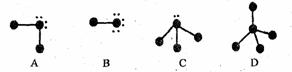
回答下列问题:
(1)A、B、C、D四种“图示”中,所表示的物质可分为四组共_________种分子。这些物质的分子中的电子总数可能为________或________。
(2)分子的空间构型为正四面体的物质的分子式是________________。该组中,物质的稳定性顺序是________________;它们沸点的变化与其余各组相比 (填“相同”或“不相同”),其原因是_______________________ 。
(3)写出上述物质中的两种间相互反应生成离子化合物的化学方程式:___________。
18、关于原子轨道的说法正确的是( )
A 、凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B 、CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C 、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
D 、凡AB3型的共价化合物,其中心原子A均采取sp3杂化轨道成键
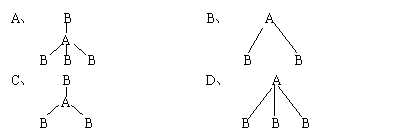
17、两种非金属元素A、B所形成的下列分子中属于非极性分子的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com