
题目列表(包括答案和解析)
4.英国研究人员 2007 年 8 月 30 日发表报告认为,全球将有 1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡 24 小时后,其含砷量才能达到食用安全标准。下列对砷 ( As )的有关判断正确的是
A.砷原子序数为 33 ,它与铝为同主族 B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强 D.砷酸的酸性比硫酸的弱
3.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习方法之一。下列对有关实验事实的解释正确的是 ( )
A.溴水中通入SO2后,颜色褪去,说明SO2表现了漂白性
B.用惰性电极电解相同浓度的Cu(NO3)2和AgNO3混合溶液,阴极首先析出的是Ag,说明Ag+ 的还原性比Cu2+ 强
C.常温下,将铝片放入浓硫酸中无明显现象,说明铝不和冷的浓硫酸反应
D.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
2.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种氢粒子是由3个氢原子核(只有质子)和2个电子构成。 对于这种粒子,下列说法正确的是
A. 是氢的一种新元素 B. 是氢的一种新的同分异构体
C. 它的组成可用H3表示 D. 它比一个普通H2分子多一个氢原子核
1.2007年世界环境日中国主题是:“污染减排和环境友好型社会”,下列有关环境问题的说法不正确的是 ( )
A.正常雨水的pH为7.0,酸雨的pH小于7.0
B.严格执行机动车尾气排放标准有利于防止大气污染
C.使用二氧化硫和某些含硫化合物进行增白的食品会对人体健康产生损害
D.使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
21.A。(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是________ ,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ __ _____________
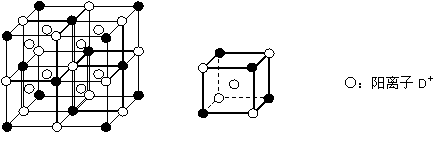
⑷C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________ 。
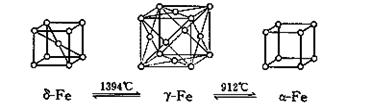
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A.γ-Fe晶体中与每个铁 原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
B.已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为: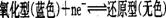
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。

某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3-5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
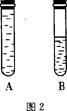
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
20、(14分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全 燃烧反应的热化学方程式是 。
(2)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35 mL 0.25 mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16 mL,恰好完全反应。
回答下列问题:
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
19、(8分)塑料是日常生活中常用的合成高分子材料,以甲烷为主要原料合成常用塑料H的线路如下:

已知:CH3CH2X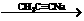 CH3CH2C≡CCH3
CH3CH2C≡CCH3
回答下列问题:
(1)反应①应控制的条件是 ,反应④的类型是 ;
(2)写出下列反应的化学方程式:
反应② ,反应⑥ 。
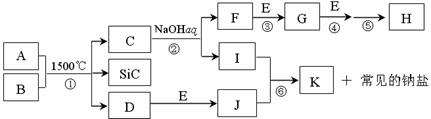
18、(10分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反
应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,
且和SiC具有相同的价电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。
反应③、④、⑤用于工业中生产H。
回答下列问题:
(1)写出下列物质的化学式:F ,I ;
(2)写出反应③的化学方程式: ;
(3)写出反应⑥的离子方程式: ;
(4)B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是
科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式:
。
17、(12分)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以丁烷为汽油代表,这个电池放电时发生的化学反应的方程式是:
;
(2)这个电池负极发生的反应是: C4H10+13O2--26e- =4CO2+5H2O,正极发生的反应是:
;固体电解质里O2-的移动方向是: 向外电路释放电子的电极是: ;
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:
;
(4)在ZrO2晶体里掺杂Y2O3,用Y3+代替晶体里的部分Zr4+对提高固体电解质的导电能
力有帮助,你认为原因是: ;
(5)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,
有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
16、(10分)某校化学小组学生利用下图装置进行“氨的催化氧化及其产物验证”实验。(图中夹持仪器已略去)
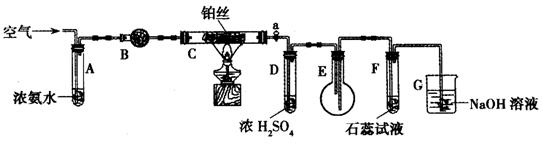
(1)装置B中盛放的试剂是_____________(填名称),用来吸收混合气体中的水蒸气。
(2)反应开始时,将装置C中铂丝加热到红热,撤去酒精灯,铂丝变暗。此时鼓入空气,铂丝又变红热。这是因为氨的催化氧化是____________反应。
(3)实验过程中,装置D中的导管处容易生成无色晶体而堵塞。为了解决该问题,可以在活塞a后增加__________(选填序号)
①盛世有蒸馏水的洗气瓶 ②盛有浓盐酸的洗气瓶 ③盛有碱石灰的U型管
(4)反应一段时间后,装置E中的气体气体颜色应为________色。此时,装置E中的含氮化合物有NH3、NO、NO2、_________(填化学式)。
(5)反应一段时间后,装置F中的紫色石蕊试液变红,其原因是(写出化学反应方程式)___________________________________________。
(6)实验结束时,应___________,并停止鼓入空气。
(7)工业上合成氨的反应是:N2(g)+3H2(g)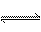 2NH3(g);H= -92.2kJ/mol。
2NH3(g);H= -92.2kJ/mol。
①下列做法能够提高工业合成氨转化率的是___________(选填字母)
a、增大压强 b、升高温度
c、使用铁解媒 d、将生成的NH3及时从混合气体中分离出去
②工业合成氨时采用500℃左右的温度,主要是因为____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com