
题目列表(包括答案和解析)
14.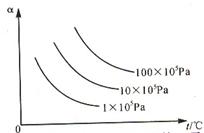 右图纵坐标为反应物的转化率,横坐标为温度(t℃), 下列符合此图情况的反应是
右图纵坐标为反应物的转化率,横坐标为温度(t℃), 下列符合此图情况的反应是
 A. C(s) + CO2(g) 2CO(g);△H > 0
A. C(s) + CO2(g) 2CO(g);△H > 0
 B. H2(g)
+ Br2(g) 2HBr(g);△H < 0
B. H2(g)
+ Br2(g) 2HBr(g);△H < 0
 C. N2(g) + 3H2(g) 2NH3(g);△H < 0
C. N2(g) + 3H2(g) 2NH3(g);△H < 0
 D.2SO3(g) 2SO2(g)
+ O2(g);△H > 0
D.2SO3(g) 2SO2(g)
+ O2(g);△H > 0
13.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于
估算化学反应的反应热( ),化学反应的
),化学反应的 等于反应中断裂旧化学键的键能之和与反
等于反应中断裂旧化学键的键能之和与反
应中形成新化学键的键能之和的差。
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1 mol化学键时放出的能量 |
436
kJ·mol-1 |
243
kJ·mol-1 |
431
kJ·mol-1 |
则下列热化学方程式不正确的是
A.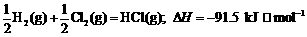
B.
C.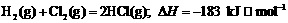
D.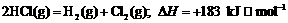
12.2008 年北京奥运会主体育场的外形好似“鸟巢” ( The Bird Nest )。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是
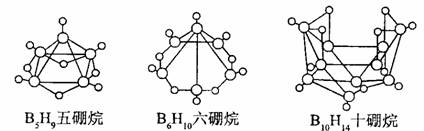
A.这类巢式硼烷的通式是 B nH n + 4
B.2B5H9 + 12O2 5B2O3
十9H2O ,l molB5H9完全燃烧转移25mol电子
5B2O3
十9H2O ,l molB5H9完全燃烧转移25mol电子
C.8 个硼原子的巢式棚烷化学式应为 B8H10
D.硼烷与水反应是非氧化还原反应
11.分析下图所示的四个原电池装置,其中结论正确的是
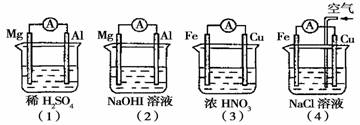
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为:6H2O+6e-→6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为:Fe→Fe2++2e-
D.(4)中Cu作正极,电极反应式为:2H++2e-→H2↑
10.常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的
A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍
B.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)=V(乙)
C.物质的量浓度c(甲)>10c(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
9.下列离子方程式正确的是
A. 明矾溶液与氢氧化钡溶液反应,使SO42- 恰好沉淀完全
Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4 + AlO2- + 2H2O
B.向碳酸氢氨溶液中加入足量氢氧化钠溶液
NH4+ + HCO3- + 2OH- = NH3•H2O + CO32- + H2O
C.Fe3O4溶于过量的氢碘酸 Fe2O3 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
D.H218O中投入Na2O2固体 2H218O + 2O22- = 4OH- + 18O2↑
8.高二(必+选)教材中有多处“讨论”,下列判断不正确的是
A.升高温度,增大压强,使用催化剂都可以使合成氨化学反应速率增大
B.铜屑与 FeCl3 溶液起反应离子方程式为:Cu+Fe3+=Fe2++Cu2+
C.强碱弱酸所生成盐的水溶液呈碱性,强酸弱碱所生成盐的水溶液呈酸性
D.湿法冶金可用于提取锌、铀及稀有金属等
7.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
下列结论正确的是 ( )
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
6.下列情况下,离子组间一定能在溶液中同时大量共存的是
A.水电离出的c(H+)=10-14mol/L的溶液中:Na+、HCO3-、Cl-、SO42-
B.PH试纸呈现红色的溶液:Fe2+、K+、NO3-、Na+
C.CO32-可以大量存在的溶液:Ag+、K+、NO3-、Al3+
D.PH=2的溶液中:SO42-、K+、NO3-、Al3+
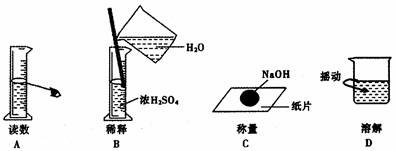
5.下图分别表示四种操作,其中至少有两处错误的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com