
题目列表(包括答案和解析)
2.(2010年福建)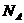 表示阿伏加德罗常数,下列判断正确的是
表示阿伏加德罗常数,下列判断正确的是
A.在18g 中含有
中含有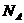 个氧原子
个氧原子
B.标准状况下,22.4L空气含有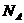 个单质分子
个单质分子
C.1 mol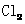 参加反应转移电子数一定为2
参加反应转移电子数一定为2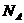
D.含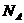 个
个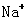 的
的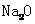 溶解于1L水中,
溶解于1L水中,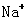 的物质的量浓度为1 mol·
的物质的量浓度为1 mol·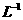
解析:本题考查阿伏伽德罗常数的计算和判断。A.18g 恰好是0.5 mol,一个氧分子正好含有两个氧原子,所以氧原子的物质的量为1 mol,即为1
恰好是0.5 mol,一个氧分子正好含有两个氧原子,所以氧原子的物质的量为1 mol,即为1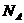 ,A正确;空气是混合物,因此标准状况下,22.4L空气中含有的单质分子不会是
,A正确;空气是混合物,因此标准状况下,22.4L空气中含有的单质分子不会是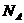 个,B错误;C.在氯气与水的反应中,1 molCl2就只转移1
个,B错误;C.在氯气与水的反应中,1 molCl2就只转移1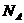 的电子,而且在反应中Cl2不一定得电子,C 错误;所得溶液中含
的电子,而且在反应中Cl2不一定得电子,C 错误;所得溶液中含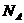 个
个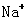 ,可知氢氧化钠的物质的量为1 mol,但这时候溶液体积不是1L,所以物质的量浓度不是1 mol·
,可知氢氧化钠的物质的量为1 mol,但这时候溶液体积不是1L,所以物质的量浓度不是1 mol·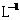 ,D错误
,D错误
答案:A

 w_w w. k#s5_
w_w w. k#s5_
1. (2010年全国2) 在一定的温度、压强下,向100mL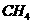 和Ar的混合气体中通入400mL
和Ar的混合气体中通入400mL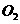 ,点燃使其完全反应,最后在相同条件下得到干燥气体460mL,则反应前混合气体中
,点燃使其完全反应,最后在相同条件下得到干燥气体460mL,则反应前混合气体中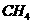 和Ar的物质的量之比为
和Ar的物质的量之比为
A.1:4 B. 1:3 C. 1:2 D. 1:1
解析:本题可以采用差量法计算。由CH4+2O2=CO2+2H2O可知每消耗1体积的甲
烷,气体体积就减少2体积。根据题给条件知实际体积减少为:100ml+400ml-460ml=40ml。所以参加反应的甲烷是20ml,则Ar的体积为80ml。故选项A正确。
答案:A
21、下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
|
|
试填空。
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)元素③与⑧形成的化合物中元素③的杂化方式为: 杂化,其形成的化合物的晶体类型是:______________ _ _。
(3)元素④、⑤的第一电离能大小顺序是: > (用元素符号表示);元素④与元素①形成的X分子的空间构型为: 。请写出与N3-互为等电子体的分子、离子的化学式 , (各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式 。
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。


20、工业生产粗硅的主要原理为:SiO2+2C Si(粗)+2CO↑。
Si(粗)+2CO↑。
(1)在制粗硅的过程中同时会有碳化硅生成,若二者物质的量之比为1:1,则参加反应的C 和SiO2的质量比为________________。
(2)工业上可通过以下原理由粗硅进一步制纯硅:
Si(粗)+2Cl2(g)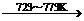 SiCl4(l);SiCl4+2H2
SiCl4(l);SiCl4+2H2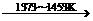 Si(纯)+4HCl
Si(纯)+4HCl
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC, 则生产25.2吨纯硅需纯度为75%石英砂多少吨?
(3)工业上还可以通过如下图所示的流程制取纯硅:
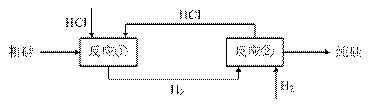
反应①:Si(粗)+3HCl(g)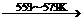 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2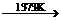 Si(纯)+3HCl
Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%。则在下一轮次的生产中,需补充投入HCl和H2的物质的量之比是多少?
19、氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2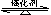 2NH3 ⊿H<0。
2NH3 ⊿H<0。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是 。
③下列关于合成氨说法正确的是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为
4NH3+3O2=2N2+6H2O
你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
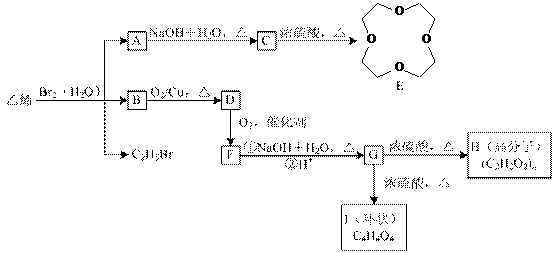
18、已知溴水中存在化学平衡:Br2+H2O HBr+HBrO,乙烯通入溴水中,生成A、B(B的化学式为C2H5BrO)和C2H5Br。
HBr+HBrO,乙烯通入溴水中,生成A、B(B的化学式为C2H5BrO)和C2H5Br。
回答下列问题:
(1)E的分子式为_______________________。
(2)B的结构简式为_____________________,I的结构简式为_______________________。
(3)写出由G转化为H的化学方程式:__________________________________________,反应类型为______________________。
(4)A-I中,能发生银镜反应的物质的结构简式是_________________________________,B→D的反应类型为_______________________。
(5)指出C的两个重要用途__________________________,_________________________。
(6)乙烯是最重要的基础石油化工原料,工业上主要通过__________________来获得乙烯。
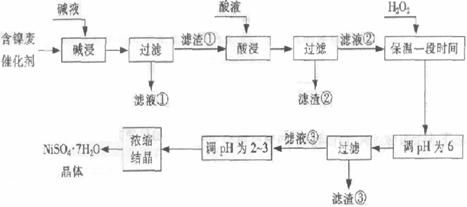
17、从含镍废催化剂中可回收镍,其流程如下:
某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。部分阳离子以氢氧化物形式完全沉淀时的pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
⑴ “碱浸”的目的是除去 。
⑵ “酸浸”时所加入的酸是 (填化学式)。酸浸后,滤液②中可能含有的金属离子是 。
⑶ “调pH为2~3”的目的是 。
⑷ 产品晶体中有时会混有少量绿矾(FeSO4·7H2O),可能是由于生产过程中
。
⑸ NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH。该反应的离子方程式是 。
16、已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性。反应生成的水均已略去。它们有如下图所示的关系。
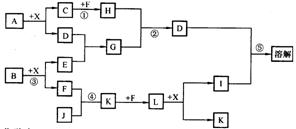
(1)写出化学式:A. ,B. ,C. 。
(2)反应③中每生成lmolF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:反应② ;
反应⑤ 。
(5)反应①中,每1.00g C与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式。 。

15、实验室里用乙醇和浓硫酸反应生成乙烯,接着再用溴与之反应生成1,2-二溴乙烷。在制备过程中由于部分乙醇被浓硫酸氧化还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷。
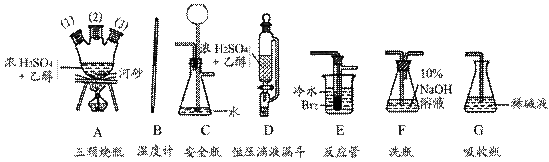
如果气体流向为从左到右,正确的连接顺序是:
B经A(1)插入A中,D接A(2);A(3)接________接________接________接________。
(2)温度计水银球的正确位置是_______________________________,若用分液漏斗代替D,可能会产生的问题是___________________________________________。
(3)F的作用是____________________________,G的作用是_________________________。
(4)在三颈烧瓶A中的主要反应的化学方程式为____________________________________。
(5)在反应管E中进行的主要反应的化学方程式为__________________________________。
(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为_______________。
14、某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
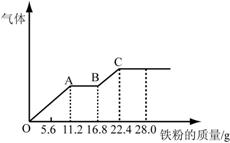 下列分析或结果错误的是
下列分析或结果错误的是
A.混合酸中NO3-物质的量为0.2 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,
BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5 mol·L-1
第二卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com