
题目列表(包括答案和解析)
2.(2010年全国2)短周期元素W 、X、 Y、 Z的原子序数依次增大,且W 、X、 Y+、 Z的最外层电子数与其电子层数的比值依次为2 、3、 4、 2(不考虑零族元素)。下列关于这些元素的叙述错误的是
A.X和其他三种元素均可形成至少2种二元化合物
B.W和X、Z两种元素分别形成的二元化合物中,均有直线形分子
C.W 、X和Y三种元素可以形成碱性化合物
D.Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
解析:本题的突破点是Y+,由于Y+的最外层电子数与其电子层数的比值为4,所以Y
是Na,所以W 、X、 Z三种元素依次为C、O、S。A正确,因为有CO、CO2、Na20、Na2O2、SO2、SO3;CO2、CS2均是直线型分子, B正确;W 、X和Y三种元素可以Na2CO3,Na2CO3溶于水显碱性,C正确;Na2S的水溶液显碱性,CS2是非电解质,D错。
答案:D
1.(2010年山东)16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A. 16O2与18O2互为同分异构体
B. 16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2与1.12L18O2均含0.1NA个氧原子
解析:同分异构体是指分子式相同而结构不同的物质,16O2与18O2的结构相同,A错;16O与18O都是氧元素的不同核素,核外电子排布方式相同,B错;化学变化的实质是旧键断裂新键形成的过程,16O与18O间的相互转化属于原子核间的变化是物理变化,C错;16O2与18O2都是双原子分子,因此在标准状况下,1.12L16O2与1.12L18O2均含0.1NA个氧原子,D正确。
答案:D
5.(2010年海南)下列物质中既有氧化性又有还原性的是
A.HClO B.Al2O3 C.N203 D.SiO2
解析:本题主要考察对氧化性和还原性的判断和理解。一般情况下凡元素化合价处于中间价态都是既有氧化性又有还原性的。选项A、C中的Cl和N元素的化合价分别为+1价和+3价,都处于中间价态,所以该物质都既有氧化性又有还原性;选项B、D中元素的化合价都处于最高价态或最低价态,不符合题意。
答案:AC


 w_w w. k#s5_
w_w w. k#s5_
4.(2010年全国2) 若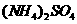 在强热时分解的产物是
在强热时分解的产物是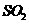 、
、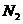 、
、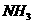 和
和 ,
,
则该反应中化合价发生变化和未发生变化的N原子数之比为

 w_w w. k#s5_
w_w w. k#s5_
A.1:4 B. 1:2 C. 2:1 D. 4:1
解析:假设反应中硫酸铵的物质的量为1mol,则N原子的物质的量为2mol。若设反
应中化合价发生变化的N原子的物质的量为amol。根据氧化还原反应中电子的得失守恒知:3a=2,解得a=2/3,所以未发生变化的N原子的物质的量为4/3mol。故反应中化合价发生变化和未发生变化的N原子数之比为2/3:4/3=1:2。
答案:B
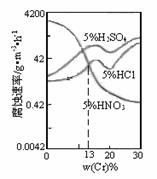
3.(2010年安徽)右图是三种稀酸对Fe – Cr合金随Cr含量变化的 腐蚀性实验结果,下列有关说法正确的是
A.稀硝酸对Fe – Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:

 w_w w. k#s5_
w_w w. k#s5_
Fe + 6HNO3(稀) == Fe(NO3)3 + 3NO2↑ + 3H2O
C.Cr含量大于13%时,因为三种酸中 硫酸的氢离子浓度最
硫酸的氢离子浓度最
大,所以对Fe – Cr合金的腐蚀性最强
D.随着Cr含量的增加,稀硝酸对Fe – Cr合金的腐蚀性减弱
解析:稀硝酸具有强氧化性,腐蚀性比稀硫酸和稀盐酸的强;浓硝酸的还原产物才
是NO2,稀硝酸是NO;Cr含量大于13%时,盐酸与硝酸中H+浓度相同,但腐蚀能力不同,
因此不能用H+浓度大小来解释腐蚀强;有图中曲线可以看出随着Cr含量的增加,稀硝
酸对Fe – Cr合金的腐蚀性是减弱的。
答案:D
2.(2010年北京)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A.CuS的溶解度大于PbS的溶解度

 w_w w. k#s5_
w_w w. k#s5_
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是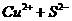
 CuS↓
CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
解析:一般说来,溶解度小的沉淀转化成溶解度更小的沉淀容易实现,CuS的溶解度小于PbS的溶解度,A错;铜蓝(CuS)中S的化合价是-2价,处于最低价态,因此具有还原性,B错;ZnS难溶应该用化学式来表示,正确的写法是:
Cu2++ZnS=Zn2++CuS↓,该反应属于复分解反应。综上所叙D正确。
 答案:D
答案:D
1.(2010年安徽)亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,基储氢原理可表示为:Li2NH
+ H2 LiNH2 + LiH,下列有关说法正确的是
LiNH2 + LiH,下列有关说法正确的是
A.Li2NH中N的化合价是-1价 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+离子半径相等 D.此储氢与钢瓶储氢原理相同
解析:Li2NH中Li、H的化合价均是+1价, N的化合价是-3价,LiH 中Li、H的化合价分别为+1价和-1价,所以在反应中H2既是氧化剂又是还原剂;H+半径是最小的,这种储氢方法是化学方法,而钢瓶储氢原理是物理方法。故选项B正确。
答案:B
15.(2010年江苏)阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为

 w_w w. k#s5_
w_w w. k#s5_
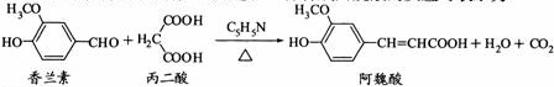
下列说法正确的是
A.可用酸性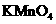 W W W K S
5 U . C O M
W W W K S
5 U . C O M
溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与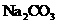 、
、 溶液反应
溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种

 w_w w. k#s5_
w_w w. k#s5_
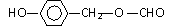 解析:本题主要考查的是有机物的结构与性质。能使酸性高锰酸钾溶液褪色的不仅有碳碳双键,酚羟基、醛基也能使其褪色,因此选项A错误;酚羟基和羧基都可以与NaOH和Na2CO3反应,香兰素和阿魏酸中分别含有酚羟基和酚羟基、羧基,因此都可以与NaOH和Na2CO3反应,所以B正确;只有醇羟基和卤代烃才有可能发生消去反应,因此选项C错误;根据条件,与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种分别为
解析:本题主要考查的是有机物的结构与性质。能使酸性高锰酸钾溶液褪色的不仅有碳碳双键,酚羟基、醛基也能使其褪色,因此选项A错误;酚羟基和羧基都可以与NaOH和Na2CO3反应,香兰素和阿魏酸中分别含有酚羟基和酚羟基、羧基,因此都可以与NaOH和Na2CO3反应,所以B正确;只有醇羟基和卤代烃才有可能发生消去反应,因此选项C错误;根据条件,与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种分别为
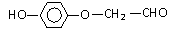 和
。综上分析可知,本题选BD项。
和
。综上分析可知,本题选BD项。
答案:BDK^S*5U.C#O%


 w_w w. k#s5_
w_w w. k#s5_
14.(2010年全国1)下图表示4-溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是

 w_w w. k#s5_
w_w w. k#s5_
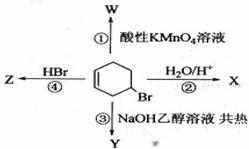
A.①④ B.③④ C.②③ D.①②
解析:已知发生四个反应得到的产物如下图所示,显然Y、Z中只含一种官能团。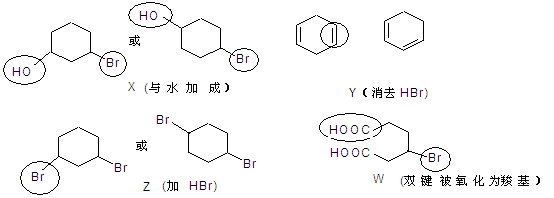 答案:B
答案:B
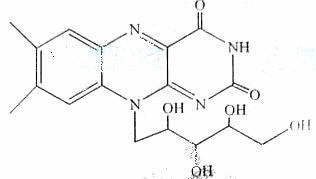
13.(2010年浙江)核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:

 w_w w. k#s5_
w_w w. k#s5_
已知: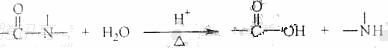
有关核黄素的下列说法中,不正确的是:
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应

 w_w w. k#s5_
w_w w. k#s5_
解析:根据键线式的特点和碳原子的四价理论知该化合物的分子式是C17H20N4O6,因此选项A 错误;由结构式可以知该化合物中含有肽键因此可以发生水解反应,由已知条件可知水解产物有碳酸和氨气生成,所以选项B、C正确;又因为该化合物中含有醇羟基,因此可以发生酯化反应,即选项D也正确。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com