
题目列表(包括答案和解析)
1.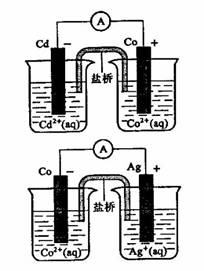 (2010年全国新课标)根据右图,可判断出
(2010年全国新课标)根据右图,可判断出
下列离子方程式中错误的是
A.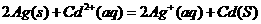
B.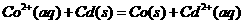
C.
D.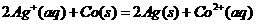
解析:在图1中Cd为负极,Co为正极,反应的方程式为:
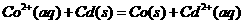 ;在图2中Co为负极,Ag为正极,反应的方程式为:
;在图2中Co为负极,Ag为正极,反应的方程式为: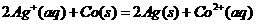 ;因此还原性是Cd>Co>Ag,所以选项A错误。
;因此还原性是Cd>Co>Ag,所以选项A错误。
答案:A
11.(2010年全国1)下面关于SiO2晶体网状结构的叙述正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.最小的环上,有6个Si原子和6个O原子
解析:二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角,所以A项错误;在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以D对,B、C都错误!
答案:D


 w_w w. k#s5_
w_w w. k#s5_
10.(2010年海南)下列描述中正确的是

 w_w w. k#s5_
w_w w. k#s5_
A、CS2为V形的极性分子
B、Cl0- 3 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO2- 3 的中心原子均为sp3杂化
解析:依据价层电子对互斥理论可知CS2为直线形的非极性分子,A错误;由价层电子对互斥理论可知Cl0- 3中中心原子的孤电子对数是1/2×(8-3×2)=1,所以Cl0- 3是三角锥形,B错误;硫原子最外层有6个电子,和氟原子之间有6对完全相同的成键电子对,C正确;SiF4和SO2- 3 的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确。
答案:C、D
9.(2010年江苏高考)已知A、B、C、D、E是短周期元素中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE具有相同类型的化学键
解析:本题主要考查的元素周期表的结构、原子结构及元素周期律的应用。因为元素D的合金是日常生活中常用的金属材料,而在短周期元素中只有铝元素,即D是铝元素;因为元素B的原子最外层电子数是其电子层数的2倍,所以B可能是碳元素或硫元素。因为B的原子序数小于D的,所以B只能是碳元素;C 的原子序数大于B而小于D且元素C在同周期的主族元素中原子半径最大,所以C为钠元素;又因为元素A、E的单质在常温下呈气态,根据原子序数的大小顺序可知A为氢元素,E为氯元素。即A为H元素、B为C元素、C为Na元素、D为Al元素、E为Cl元素。A项,由C、H元素组成的化合物主要是烃类化合物,在常温下,不一定呈气态;B项,其对应的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,二者能反应;C项,对于Na、Al、Cl2的制备,在工业上都采用电解的方法;D项,化合物AE和EC,分别是HCl和NaCl,前者只含有共价键,后者只含有离子键。综上分析可知,本题选BC项。
答案:BC
8.(2010年浙江)有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
解析:本题的突破点是Y,由Y的性质知Y是硅元素,即X、Y、Z、W属于第三周期,根据X、Z、W的简单离子可知X、Z、W分别属于钠、硫、氯元素。因为Z、M同主族且X+与M2-具有相同的电子层结构,所以M是氧元素。选项A中钠和氧还可以形成Na2O2,A错误;由于水分子中存在氢键,所以水的沸点最高,B错误;元素Y、Z、W的单质晶体分别属于原子晶体、分子晶体、分子晶体,C 错误;Cl2和O3可以作为消毒剂,故D正确。
答案:D
7.(2010年上海)几种短周期元素的原子半径及主要化合价如下表:

 w_w w. k#s5_
w_w w. k#s5_
|
元素代号 |
X |
Y |
Z |
W |
|
原子半径/pm |
160 |
143 |
70 |
66 |
|
主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
答案:本题主要考查了物质结构与元素周期律知识。根据题给数据,X、Y的化合价不同,但原子半径相差较小,可知两者位于同一周期相邻主族,故金属性X>Y,A错;根据Z、W的原子半径相差不大,化合价不同,且W只有负价,则其可能是O,Z是N,两者的单质直接生成NO,B错;据表中数据判断可知X是Mg,Y是Al;Y的最高价氧化物的水化物是氢氧化铝,不溶于氨水,C错;一定条件下,氧气可以和氨气反应生成水和氮气,D对。
答案:D
6.(2010年全国高考1)下列判断错误的是

 w_w w. k#s5_
w_w w. k#s5_
A.沸点: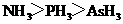 B.熔点:
B.熔点: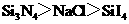
C.酸性: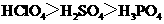 C.碱性:
C.碱性: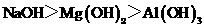
解析:B考查不同类型晶体的熔沸点高低,2008年高考全国卷I第8题已经考过,一般认为是:原子晶体>离子晶体>分子晶体,所以B正确; C项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;D正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。A项错误,2009年高考全国卷I第29题已经考过,NH3分子间存在氢键,故最高,AsH3、PH3分子间不存在氢键,只有范德华力,组成和结构相似的分子相对分子质量越大,其分子间作用力越大,熔沸点越高故应该为:NH3>AsH3>PH3;
答案:A
5.(2010年四川)下列说法正确的是

 w_w w. k#s5_
w_w w. k#s5_
A. 原子最外层电子数为2的元素一定处于周期表IIA族
B. 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5
C. 氯化氢的沸点比氟化氢的沸点高
D. 同主族元素形成的氧化物的晶体类型均相同
解析:本题考查物质结构知识;本题可用举例排除法,氦原子最外层电子数为2,为零族,A项错误;MgCl2中原子序数之差为5,CO2中原子充数之差为2,B项正确;由于HF中存在氢键,故HF的沸点比HCl的高,C项错误;第IA中H2O为分子晶体,其它碱金属氧化物为离子晶体,D项错误。
答案:B
4.(2010年海南)短周期元素X、Y、Z所在的周期序数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
解析:本题主要考察元素周期表的结构、原子核外电子排布及化学键的有关知识。因为X、Y、Z属于短周期,且Y2-与Z+核外电子层的结构相同,因此Y、Z分别便属于ⅥA和IA,因此Y、Z分别属于O和Na元素;又因为X、Y、Z的原子序数之和为20,所以x属于H元素。因此要同时存在极性和非极性共价键的化合物只有H2O2了。所以选项B正确。
答案:B
3.(2010年山东)下列说法正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强

 w_w w. k#s5_
w_w w. k#s5_
D.元素周期律是元素原子核外电子排布周期性变化的结果
解析:离子键是阴阳离子间的静电作用,包括引力和斥力,A错;根据元素周期律 ⅦA自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,还原性逐渐增强,B错;第三周期非金属元素最高价含氧酸的酸性从左到右依次增强,而不是含氧酸的酸性,C错。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com