
题目列表(包括答案和解析)
1、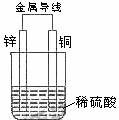 铜片和银片用导线连接后插入某氯化钠溶液中,铜片是( )
铜片和银片用导线连接后插入某氯化钠溶液中,铜片是( )
A、阴极 B、正极 C、阳极 D、负极
10、测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)1999年高考
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
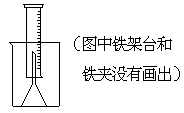 (2)合金样品用铜网包裹的目的是:
(2)合金样品用铜网包裹的目的是:
正确答案及评分标准 (1)②往烧杯中注入水,直至水面没过漏斗颈。(没答水面没过漏斗颈不给分)(3分) ③在100毫升量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中。烧杯中水面到杯口至少保留约100毫升空间。(只要黑斜体中的要点全部答对给3分,装满水的量筒怎样倒置在杯中可不作要求,答或不答不加分也不扣分)(3分) ④将长颈漏斗(或答玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生(3分) 注:实验步骤顺序写错,或者步骤②中加入盐酸,则不论其它步骤回答是否正确,小题(1)均为0分。
(2)使样品在反应时能保持在烧杯底适当的位置(或答避免反应时样品漂浮)(2分)
9.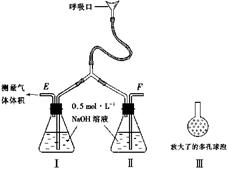 为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空。
为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空。
(1)图中瓶II的作用是
______________________________。 (2) 对实验装置尚有如下A、B、C、D四种建议,你认为合理的是___________________。(填代号) A. 在E处增加CaCl2干燥管 B.在下处增加CaCl2燥管 C.在E和F两处增加CaCl2干燥管 D.不必增加干燥管 (3)将插入溶液的管子丁端改成具有多孔的球泡(图中的皿),有利于提高实验的准确度, 其理由是_____________。 (4)实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集到的气体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式) __________________。 (5)实验中若猛吸猛呼,会造成不安全后果,猛吸时会______________________。猛呼时会_______________________
正确答案及评分标准 (1)除去吸人空气中的CO2 (2分) (2) D (2分) (3)可增大气体与溶液的接触面积,使气体中的(CO2被充分吸收(3分) (说明;只要答出其中一点,就给3分) (4)[(ag/44g·mol-1)×22.4L·mol-1]/[bL+(ag/44g.mol-1×22.4L·mol-1)]
或:(22.4L·mol-1×ag)/(bL×44g·mol-1+ag×22.4Lmol-1)×(5.6a/11b+5.6a)
×(5.6a/11b+5.6a)×100% (3分) (5)把瓶1中的NaOH溶液吸人口中;把瓶II中的NaOH溶液吹出瓶外。(各2分,共4分)
8、某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的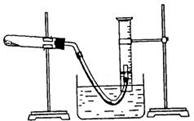 试管中,准确称量,质量为ag。
试管中,准确称量,质量为ag。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为bg。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性?
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量简内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量简内外液面的高度相同?
(4)如果实验中得到的氧气体积是c L(25℃、1.0×105Pa)的,水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)=
7、实验室可用氯气与金属反应制备无水三氯化铁,该化合物呈棕红色、易潮解100℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
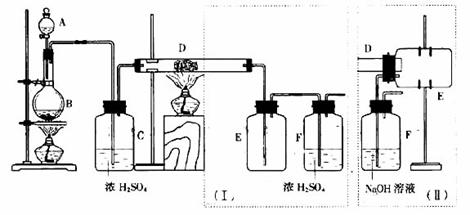
(1) B中反应的化学方程式为:__________________;
(2) D中的反应开始前,需排除装置中的空气,应采取的方未能是:_________________________。
(3) D中反应的化学方程式为:__________________________。
(4) 装置(Ⅰ)的主要缺点是:______________________。
(5) 装置(Ⅱ)的主要缺点是:___________________________,
如果选用些装置来完成实验,则必须采取的改进措施是:
正确答案及评分标准
(1)4HCl+MnO2?MnCl2+2H2O+Cl2↑ (3分)
或 16HCl+2KmnO4?2KCl+2MnCl2+8H2O+5Cl2↑ (3分)
(2)B中的反应进行一段时间后,看到黄绿色气体充满装置,现开始加热D (3分)
(3)2Fe+3Cl2?2FeCl3 (2分)
(4)导管易被产品堵塞;尾气排入空气,易造成环境污染 (2分)
(5)产品易潮解 (2分)
在瓶E和F之间连接装有干燥剂的装置 (2分)
(其他既能防止产品潮解又能防止尾气污染环境的合理答案均给分)
6、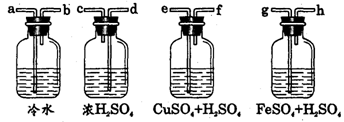 实验室用Zn粒和盐酸反应制H2,其中含酸雾、水气、硫化氢及少量氧气等杂质气体,某同学设计了以下几种装置,按一定顺序连接,气体通过时,达到每一装置除去一种气体的目的。
实验室用Zn粒和盐酸反应制H2,其中含酸雾、水气、硫化氢及少量氧气等杂质气体,某同学设计了以下几种装置,按一定顺序连接,气体通过时,达到每一装置除去一种气体的目的。
(1)它们连接的顺序为 ;
(2)除去H2S的离子方程式为 ;
(3)除去O2观察到的现象为
。
答案:(1)a→b→e→f→g→h→d→c;(2)H2S+Cu2+= CuS↓+2H+;
(3)溶液由浅绿色逐渐变成黄色
3、欲制无水氯化铝并保存备用。现有仪器如下图所示,并有食盐晶体、水、固体烧碱、铝粉、二氧化锰、浓硫酸等六种试剂。
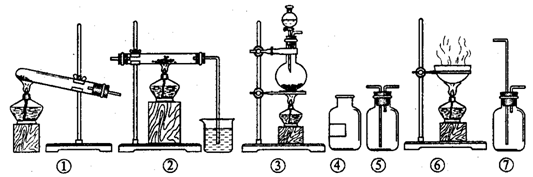 设计的制取过程是:制氯气 → 加净化和干燥氯气 → 制氯化铝
设计的制取过程是:制氯气 → 加净化和干燥氯气 → 制氯化铝
请回答下列问题:
(1)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(不一定填满),并写出各仪器里放入的试剂的化学式
(2)写出实验过程中有关反应的化学方程式。
答案:⑴③、 ⑦、 ⑤、 ②
NaCl,MnO2,浓H2SO4、NaCl,H2O、浓H2SO4、Al,NaOH,H2O
⑵2NaCl+3H2SO4+MnO2
 2NaHSO4+MnSO4+2H2O+Cl2↑
2NaHSO4+MnSO4+2H2O+Cl2↑
Cl2+2NaOH=NaCl+NaClO+H2O
2Al+3Cl2  2AlCl3
2AlCl3
5、 实验室利用乙醇脱水制备乙烯的步骤如下;
实验室利用乙醇脱水制备乙烯的步骤如下;
①在一蒸馏烧瓶中加人95%的乙醇和浓硫酸(体积比为l:3),再加入少量干净的河沙;
②瓶口插上带塞的温度计;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,用酸性KMnO4溶液检验乙烯的还原性。
据此回答下列问题:
(1)步骤①中混合乙醇和浓硫酸时应注意的问题是 。
(2)在反应液中加入河沙的原因是 。
(3)步骤②中温度计水银球的正确位置是 。
(4)加热时,使反应液温度迅速升高到I7O℃的原因是 。
(5)步骤④中.用稀NaOH溶液洗涤气体,能除去可能伴随乙烯生成的气体是 。
答案:(1)将浓硫酸缓慢加入乙醇中并不断搅拌,必要时冷却。(2)河砂对乙烯的生成有催化作用,且能防止反应中形成大量的泡沫。(3)温度计水银球应浸没于反应液中。(4)若温度在1400C,生成的主要物质是乙醚并非乙稀。(5)硫酸与乙醇发生氧化还原反应生成的CO2及SO2
4、回答下面问题:
(l)分离沸点不同但又互溶的液体混合物,常用什么方法?
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静量分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
3、将1体积选项中的一种气体与10体积O2混合后,依次通过盛有足量浓NaOH溶液的洗气瓶和盛有足量灼热铜屑的管子(假设反应都进行完全),最后得到的尾气可以是( )。
A.Cl2 B.CO C.CO2 D.N2
分析与解答:
本题将选项中的物质作为可选择的反应物,又要推出反应后的最终产物可能是选项中的何物。试题新颖、灵活,要善于比较,培养思维的辩证性。解题时应用选项中的四种气体,分别进行上述实验,如将B选项中的CO进行实验:CO、O2都不与NaOH溶液反应,O2与Cu反应生成CuO,CuO又与CO反应,生成CO2,尾气为CO2。同理D选项的N2进行实验,尾气为N2。正确答案为C、D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com