
题目列表(包括答案和解析)
4.(2010年福建)下列各组物质中,满足下图物质一步转化关系的选项是

 w_w w. k#s5_
w_w w. k#s5_
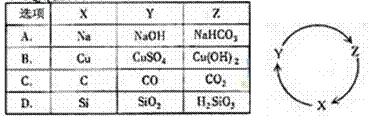
解析:本题主要考查对常见元素及其化合物之间都相互转化,依据题意可采用可用代入法,即把各选项中的X、Y、Z代入右图的圆圈中进行判断。A中NaHCO3不能生成Na ;B中Cu(OH)2不能生成Cu;D中Si不能生成SiO2,H2SiO3也不能生成Si ;而C中可以一步转化,有关的反应方程式为:2C+O2 2CO、2CO+O2
2CO、2CO+O2 2CO2、CO2+C
2CO2、CO2+C 2CO。K^S*5U.C#O%
2CO。K^S*5U.C#O%
答案:C
3.(2010年上海高考)下列判断正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109.28′
解析:本题主要考查了物质的分类、晶体的构造和分子的构型等知识点。酸酐中大多数是氧化物,但醋酸酐(C4H6O3)就不是氧化物,A错;惰性气体都是单原子分子,其晶体中只存在分子间作用力,不存在化学键,B错;碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,例如Al2O3是两性氧化物,Mn2O7是酸性氧化物,C正确;正四面体分子中,白磷分子的键角是60o,D错。
答案:C
2.(2010年上海)下列有关物质性质的描述不符合事实的是

 w_w w. k#s5_
w_w w. k#s5_
A.有机物不导电 B.金刚石是自然界最硬的物质
C.SO2可用作食品防腐剂 D.NO可用于某些疾病的治疗
解析:本题考查了常见物质的性质和用途。绝大多数的有机物是不导电的,但聚乙炔塑料等少数有机物就能导电,A错;金刚石是自然界中最硬的物质,B对;二氧化硫可以杀菌消毒,可做食品和干果的防腐剂,C正确;NO可用于心血管疾病的治疗,D正确。
答案:A
1.(2010年江苏)下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂[
C.盐析可提纯蛋白质并保持其生理活性
D.石油分馏可获得乙烯、丙烯和丁二烯
解析:本题主要考查的是常见物质在生产生活中的应用。A项,SiO2是光纤制品的主要原料,A正确;水玻璃是硅酸钠的水溶液,能作为粘合剂和防火材料,选项B正确;C项,盐析属于物理变化,是提纯蛋白质的一种方法,而且不影响蛋白质的生理活性,因此选项C正确;石油分馏得到的是不同沸点的烃类化合物,如汽油、煤油、柴油等,只有通过裂解或裂化的方法可得到乙烯等不饱和的烃类物质,所以选项D错误。综上分析可知,本题选D项W W W K S 5 U . C O M
答案:D
2.平衡状态的特征:
动:动态平衡 等:υ(正)=υ(逆)
定:各组分的浓度不再发生变化;
变:如果外界条件的改变,原有的化学平衡状态将被破坏。
例32.在一定条件下,对于密闭容器中进行的可逆反应:N2(g)
+ 3H2(g) 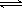 2NH3(g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是
( )。
2NH3(g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是
( )。
A.N2、H2、NH3在密闭容器中共存 B.N2、H2、NH3的浓度不再变化
C. N2、H2、NH3的浓度相等 D.反应停止,正、逆反应速率都等于零
1. 对于可逆反应,在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,反应达到化学平衡状态。
浓度、温度、催化剂,压强(有气体参与的反应)、固体的表面积等。
①通常浓度越大(气体或溶液),反应速率越快; ②温度越高,反应速率越快;
③压强越大,反应速率越快(仅对有气体物质的反应); ④催化剂能改变化学反应速率。
例29.在2 L的密闭容器中,充人2 molN2和3 molH2,在一定条件下反应,3 s后测得N2为0.8 mol,N2的反应速率为 0.2mol/(L•s ) ;H2的反应速率为 0.6mol/(L•s ) 。
例30.下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增大压强 C.升高温度 D.使用催化剂
例31.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是D
A.盐酸的浓度 B.铝条的表面积
 C.溶液的温度 D.加少量Na2SO4
C.溶液的温度 D.加少量Na2SO4
(1)用单位时间内反应物浓度的减小或生成物浓度的增加来表示。
计算公式为=△C / △t 时间:(如每秒、每分、每小时)
反应速率的单位:mol/(L•s ) mol/(L•min) mol/(L•h)
(2)同一反应各物质的反应速率之比等于化学计量数之比。例:
2A(g)+3B (g)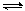 C(g)+4D(g) ν(A):ν(B):ν(C):ν(D) = 2 :3 :1 :4
C(g)+4D(g) ν(A):ν(B):ν(C):ν(D) = 2 :3 :1 :4
4、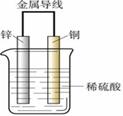 铜锌原电池和电极反应:如图所示装置的叙述,
铜锌原电池和电极反应:如图所示装置的叙述,
负极是 ,电极方程式为 属于 反应
正极是 ,电极方程式为 属于 反应
电子从 流向 ; 极逐渐溶解,溶液PH值变
例27.下列说法正确的是( )
A.原电池是把电能转化为化学能的装置
B.原电池中电子流出的一极是正极发生氧化反应
C.原电池的两极发生的反应均为氧化还原反应
D.形成原电池后,原电池中的阳离子向正极移动
例28. 把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
第三节 化学反应的速率和限度
3、电极名称:
负极:一般为活泼金属,失电子,化合价升高,发生 反应。
正极:一般为较不活泼金属(或非金属),溶液中阳离子得电子,化合价降低,发生 反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com