
题目列表(包括答案和解析)
4.(2010年全国新课标)己知: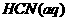 与
与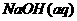 反应的
反应的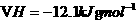 ;
;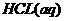 与
与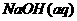 反应的
反应的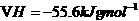 。则
。则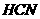 在水溶液中电离的
在水溶液中电离的 等于
等于

 w_w w. k#s5_
w_w w. k#s5_
A.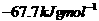 B.
B.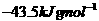
C.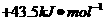 D.
D. 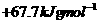
解析:由盖斯定律可知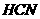 在水溶液中电离的
在水溶液中电离的 为:+(55.6-12.1)KJ·mol-1=+43.5 KJ·mol-1,所以选项C正确。
为:+(55.6-12.1)KJ·mol-1=+43.5 KJ·mol-1,所以选项C正确。
答案:C
3.(2010年山东)下列与化学反应能量变化相关的叙述正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
解析:化学反应分为放热反应和吸热反应,若生成物总能量低于反应物总能量的则为放热反应,反之是吸热反应,A错误;反应速率与反应是否放热还是吸热无关,B错误;反应的焓变△H与反应条件无关,D错误。所以选项C正确。
答案:C
2.(2010年重庆) 已知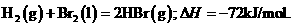 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:

 w_w w. k#s5_
w_w w. k#s5_

则表中a为
A.404 B.260 C.230 D.200
解析:本题考查盖斯定律的计算。由已知得:Br2(l)=Br2(g) DH=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);DH= -102KJ/mol。436+a-2×369=-102;a=―200KJ,D项正确。
答案D
1.(2010年全国2)下面均是正丁烷与氧气反应的热化学方程式(25°,101kPa):
① 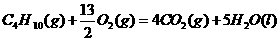
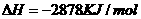
②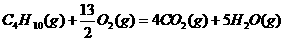
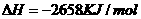
③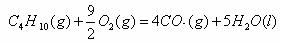
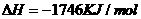
④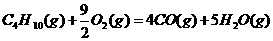
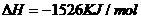
由此判断,正丁烷的燃烧热是
A.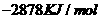 B.
B. 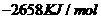
C.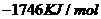 D.
D.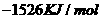
解析:燃烧热是指在25℃、101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,综上所叙选项A正确。
答案:A
17.(2010年浙江)下列关于实验原理或操作的叙述中,不正确的是:

 w_w w. k#s5_
w_w w. k#s5_
A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
B.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
C.纸层析实验中,须将滤纸上的试样点浸入展开剂中
D.实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法
解析:乙醇和水互溶,因此萃取单质碘时不能用无水乙醇代替CCl4,A正确;甘油可以与新制的Cu(OH)2悬浊液反应生成一种绛蓝色的络合物,所以B正确;纸层析实验中,滤纸上的试样点是不可以浸入展开剂中的,C错误;乙酸可以和生石灰反应,因此选项D正确。
答案:C


 w_w w. k#s5_
w_w w. k#s5_
16.(2010年江苏)下列实验操作与预期实验目的或所得实验结论一致的是

 w_w w. k#s5_
w_w w. k#s5_
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是K2CO3 |
|
B |
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去MgCl2溶液中少量FeCl3 |
|
C |
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下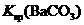 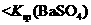 |
|
D |
C2H5OH与浓硫酸170℃共热,制得的气体通人酸性KmnO4溶液 |
检验制得气体是否为乙烯 |
解析:本题主要考查的是实验基本操作。与盐酸反应产生CO2气体的不一定是CO32-,也有可能是HCO3-,因此A错误;Fe3+水解显酸性,加入Mg(OH)2、MgO等物质能促使Fe3+的水解转化为Fe(OH)3沉淀,从而除去可以FeCl3,同时也不会引进新杂质,B正确;根据实验现象,说明沉淀中有BaCO3,但这并不能说明Ksp(BaCO3)与Ksp(BaSO4)的大小关系,因为沉淀的转化还与离子的浓度大小有关系,所以选项C也错误;在乙醇制取乙烯的实验中,还可能有副反应产生的SO2也能使酸性高锰酸钾溶液褪色,因此D错误。综上分析可知,本题选B项。
答案:B
15.(2010年上海)下列判断正确的是
A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH
D.1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L 1mol·L-1硫化钠溶液吸收SO2的量
解析:本题主要考查了实验操作、化学反应中的能量变化、溶液的pH大小比较、元素化合物等知识。测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,说明部分硫酸铜分解生成了氧化铜,测定值大于理论值,A错;氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1mol氢分子所具有的能量,B错;碳酸的酸性弱于醋酸,依据水解原理越弱越水解可知,相同浓度的碳酸钠溶液的pH大于相同浓度的醋酸钠溶液的pH,C对;碳酸钠溶液可以和SO2发生如下反应:Na2CO3+2SO2+H2O=2NaHSO3+CO2↑;硫化钠溶液可以和SO2发生如下反应:2Na2S+5SO2+2H2O=4NaHSO3+3S↓;当碳酸钠和硫化钠的物质的量相等时,很明显硫化钠溶液吸收SO2的量多,D错。
答案:C
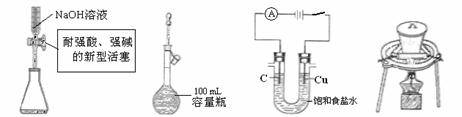
14.(2010年北京)用右图所示实验装置
(夹持仪器已略去)探究铜丝与过量浓
硫酸的反应。下列实验不合理的是
A.上下移动①中铜丝可控制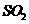 的量
的量
B.②中选用品红溶液验证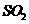 的生成
的生成
C.③中选用NaOH溶液吸收多余的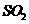


 w_w w. k#s5_
w_w w. k#s5_
D.为确认CuSO4生成,向①中加水,观察颜色
解析:为确认CuSO4生成,应该是冷却后将①中的液体慢慢倒入盛有少量水的另一只试管里,观察溶液的颜色。
答案:D
13.(2010年安徽)下列实验操作或装置符合实例实验要求的是

 w_w w. k#s5_
w_w w. k#s5_
A.量取15.00 mL B.定容 C.电解制Cl2、H2 D.高温燃烧石灰石
NaOH溶液
解析:定容时离刻度线1-2cm处再用胶头滴管,B错误;电解饱和食盐水处阳极材料只能用惰性电极,C错误;酒精灯达不到高温,且此时坩埚加热时不能加盖,D错误。
 答案:A
答案:A
12.(2010年江苏)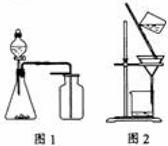 下列有关实验原理或操
下列有关实验原理或操
作正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.选择合适的试剂,用图1所示装置
可分别制取少量
B.制备乙酸乙酯时,向乙醇中缓慢
加入浓硫酸和冰醋酸
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.用广泛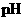 试纸测得0.10mol·L
试纸测得0.10mol·L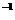 NH4Cl溶液的
NH4Cl溶液的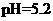
解析:本题主要考查的是实验的基本知识。,装置图1的特点是反应不需要加热且收集气体的密度大于空气的,但NO不能用排空气法收集,因此A错;乙醇的密度比水的还小,所以实验室制备乙酸乙酯时,先在试管中放入乙醇,在慢慢加入浓硫酸,冷却后,再加入乙酸,因此选项B正确;洗涤沉淀时,在过滤器中的沉淀中,加入蒸馏水,浸没沉淀,让水自然流下,不用玻璃棒搅拌,所以选项C错误; W W W K S 5 U . C O M
pH试纸只能粗略测定溶液酸碱度的数值范围,但不能测得溶液具体的pH值,所以选项D 错误。综上分析可知,本题选B项。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com