
题目列表(包括答案和解析)
8.(2010年上海)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g) 

 w_w w. k#s5_
w_w w. k#s5_
下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O
可提高CO2和H2的利用率
解析:本题主要考查化学反应速率和化学平衡知识。催化剂能提高化学反应速率,加快反应进行,也就是提高了生产效率,A对;反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,B错;充入大量CO2气体,能使平衡正向移动,提高H2的转化率,C对;从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,D对。答案:B


 w_w w. k#s5_
w_w w. k#s5_
6.(2010年海南)对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.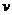 (W)=3
(W)=3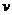 (Z) B.2
(Z) B.2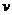 (X)=3
(X)=3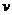 (Z)
(Z)
C.2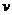 (X)=
(X)=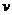 (Y) D.3
(Y) D.3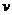 (W)=2
(W)=2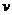 (X)
(X)
解析:本题主要考察化学反应速率和化学计量数的关系。根据化学反应速率是用单位时间内反应物浓度的减少或生成物浓度的增加来表示的,所以化学反应速率之比等于其相对于的化学计量数之比,即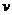 (W):
(W):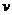 (X):
(X):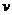 (Y):
(Y):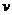 (Z)=3:2:4:3,因此选项C正确。
(Z)=3:2:4:3,因此选项C正确。
答案:C
6.(2010年江苏高考)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下

 w_w w. k#s5_
w_w w. k#s5_
(已知
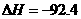 kJ·mol
kJ·mol ):
):
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L ) ) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
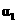 |
 |
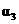 |
下列说法正确的是
A.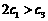 B.
B.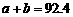 C.
C. D.
D.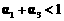
解析:本题主要考查的是化学平衡和反应热的有关知识。在等温等容时,若起始物质的量不同,则转化率也不同,也不成倍数关系,应该是2 c1<c3,A错误;B项,实际上为等效平衡,不同的是反应的起始方向不同,因此过程中乙吸收的热热量相当于过程甲甲完全转化需再放出的热量,故a+b=92.4,B正确;C项,根据平衡的建立过程,通过模拟中间状态分析,丙的转化率小于乙,故2p2>p3,C错误;因为甲、乙两过程属于等效平衡,所以a1+a2=1,而a2> a3,所以a1+ a3<1.综上分析可知,本题选BD项。
答案:BD

 w_w w. k#s5_
w_w w. k#s5_
5.(2010年北京)某温度下,  的平衡常数
的平衡常数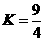 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是

 w_w w. k#s5_
w_w w. k#s5_
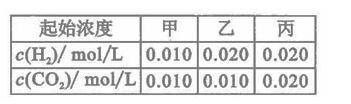
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
解析:甲中设平衡时生成物的物质的量浓度为x,则有: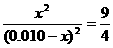 ,解得x=0.006,所以H2、CO2的转化率均为60%,此时CO2的浓度是0.004。反应前后体积不变,因此甲和丙中的平衡等效,B正确;由于容器的容积相同,所以平衡时,丙中c(CO2)是甲中的2倍,是0.008mol/L,C错;乙可以看作是在甲的基础上增大氢气的物质的量浓度,所以可以提高CO2的转化率,A正确;浓度越高,压强越大,反应越快,D正确;
,解得x=0.006,所以H2、CO2的转化率均为60%,此时CO2的浓度是0.004。反应前后体积不变,因此甲和丙中的平衡等效,B正确;由于容器的容积相同,所以平衡时,丙中c(CO2)是甲中的2倍,是0.008mol/L,C错;乙可以看作是在甲的基础上增大氢气的物质的量浓度,所以可以提高CO2的转化率,A正确;浓度越高,压强越大,反应越快,D正确;
答案:C
4.(2010年重庆) 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是

 w_w w. k#s5_
w_w w. k#s5_
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
解析:本题考查化学平衡的移动。该反应为体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
答案B
3.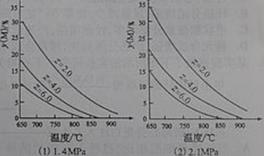 (2010年四川)反应aM(g)+bN(g)
(2010年四川)反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
平衡时M的体积分数与反应条件的关系
A. 同温同压同Z时,加入催化剂,平衡时Q的体积分数增加

 w_w w. k#s5_
w_w w. k#s5_
B. 同压同Z时,升高温度,平衡时Q的体积分数增加
C. 同温同Z时,增加压强,平衡时Q的体积分数增加
D. 同温同压时,增加Z,平衡时Q的体积分数增加。
解析:本题考查了平衡移动原理的应用。A项加入催化剂只能改变反应速率,不会使平衡移动。B项由图像(1)知随着温度的升高M的体积分数降低,说明正反应吸热,所以温度升高平衡正向移动,Q的体积分数增加。C项对比(1)(2)可以看出在相同温度时,压强增大M的体积分数增大,所以正反应是体积缩小的反应,增大压强Q的体积分数减小。D项由C项可以判断D也不对。
答案:B
3. (2010年福建)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4-8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是
(2010年福建)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4-8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是

 w_w w. k#s5_
w_w w. k#s5_
K^S*5U.C#O
A.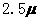 mol·L-1·min-1和
mol·L-1·min-1和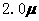 mol·L-1
mol·L-1
B.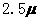 mol·L-1·min-1和
mol·L-1·min-1和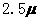 mol·L-1
mol·L-1
C.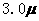 mol·L-1·min-1和
mol·L-1·min-1和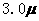 mol·L-1
mol·L-1
D.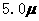 mol·L-1·min-1和
mol·L-1·min-1和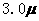 mol·L-1
mol·L-1
解析:本题考查化学反应速率的计算。由图像可知第8分与第4分时反应物浓度差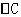 为
为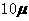 mol·L-1·min-1,△t为4分,所以在4-8min间的平均反应速率为
mol·L-1·min-1,△t为4分,所以在4-8min间的平均反应速率为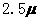 mol·L-1·min-1,可以排除C、D两个答案;图中从0min开始到8min反应物浓度降低了4倍,根据这一幅度,可以推测从第8min到第16min应该也降低了4倍,即由
mol·L-1·min-1,可以排除C、D两个答案;图中从0min开始到8min反应物浓度降低了4倍,根据这一幅度,可以推测从第8min到第16min应该也降低了4倍,即由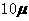 mol·L-1·min-1降低到
mol·L-1·min-1降低到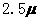 mol·L-1·min-1,因此推测第16min反应物的浓度为
mol·L-1·min-1,因此推测第16min反应物的浓度为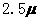 mol·L-1·min-1,所以可以排除A而选B。
mol·L-1·min-1,所以可以排除A而选B。
答案:B
2.(2010年海南)光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡:
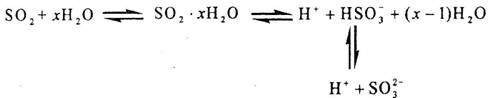
据此,下列判断中正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.该溶液中存在着SO2分子
B.该溶液中H+浓度是SO32-浓度的2倍
C.向该溶液中加入足量的酸都能放出SO2气体
D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液
解析:本题主要考察化学平衡状态的特点和外界条件对化学平衡对影响。因为该反应是可逆反应,所以达到平衡后反应物和生成物共同存在与体系中,所以选项A正确;溶液中H+的来源有3个方面,即水的电离、SO2·xH2O和HSO3-的电离,因此溶液中H+浓度不一定是SO32-浓度的2倍,选项B错误;SO2是一种还原性气体,若加入的酸是氧化性酸,SO2将被氧化成硫酸而不会放出SO2气体,选项C错误;NaHSO3是一种酸式盐可以与NaOH反应,方程式为NaHSO3+NaOH=Na2SO3+H2O,选项D也错误。
答案:A
1.(2010年安徽)低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:
2NH3(g)
+ NO(g)  2N2(g) + 3H2O(g) ΔH<0
2N2(g) + 3H2O(g) ΔH<0
在恒容密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
解析:该反应是放热反应,温度升高平衡向逆反应方向移动,平衡常数减小;增大反应物氨浓度,氮氧化物的转化率增大;催化剂不能使平衡移动即转化率不会改变。单位时间内消耗NO和N2的物质的量比为1∶2时,即表明正逆反应已经相等,反应达到平衡,属于选项C正确。
答案:C
5.(2010年福建)下列有关化学研究的正确说法是

 w_w w. k#s5_
w_w w. k#s5_
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散素分为溶液、胶体与浊液
D.从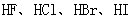 酸性递增的事实,推出
酸性递增的事实,推出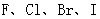 的非金属性递增的规律
的非金属性递增的规律
解析:本题侧重考查反应速率、盖斯定律、分散系、元素周期律等重要的基本概念及其规律。
A.同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律。K^S*5U.C#O%
B.这是盖斯定律的表述。
C.分散系的划分是以分散质颗粒大小来区分的。K^S*5U.C#O%
D.在以酸性强弱作为判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据的。
答案:B


 w_w w. k#s5_
w_w w. k#s5_
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com