
题目列表(包括答案和解析)
17.(1)图4-7为CO2分子晶体结构的一部分。观察图形,试说明每个CO2分子周围有______个与之紧邻等距的CO2分子;
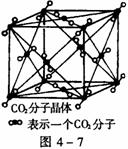
(2)试判断:①CO2、②CS2、③SiO2晶体的沸点由高到低排列的顺序是______>______>______(填写相应物质的编号)。
16.如图4-6,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。
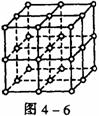
这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体的结构示意图。
(2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-离子为该晶胞与其相邻的晶胞所共有。一个晶胞中,Cl-离子的个数等于______,即______(填计算式),Na+离子的个数等于_______,即__________(填计算式)。
(4)设NaCl的摩尔质量为M g/mol,食盐晶体的密度为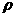 g/cm3,阿伏加德罗常数为NA。食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
g/cm3,阿伏加德罗常数为NA。食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
15.在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有______(填数字)个碳原子,每个碳原子上的任意两个C-C键的夹角都是______(填角度)。
14.下表所列数据是在不同物质中氧-氧之间的键长和键能的实测数据,其中a和b尚未测出,但根据一个较为可靠的原则可估计a、b、c、d的大小顺序为_______,该原则可简述为________________________________。
|
|
键长(pm) |
键能(kJ/mol) |
|
O22- |
149 |
a |
|
O2- |
128 |
b |
|
O2 |
121 |
c=494 |
|
O2+ |
112 |
d=628 |
13.NH3、H2S是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述实例可推出ABn型分子是非极性分子的经验规律是( )
A.分子中不能含有氢原子
B.在ABn分子中A原子没有孤对电子
C.在ABn分子中A的相对原子质量小于B的相对原子质量
D.分子中每个共价键的键长应相等
12.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2 B.NaCl和HCl
C.CCl4和KCl D.CO2和H2O
11.下列化学式可表示一个分子的是( )
A.SiO2 B.NH4Cl C.CCl4 D.C
10.带静电的有机玻璃棒靠近下列液体的细流,细流会发生偏转的是( )
A.苯 B.二硫化碳 C.溴水 D.四氯化碳
9.在短周期中的X和Y两元素可组成化合物XY3,下列说法正确的是( )
A.若X的原子序数为m,则Y的必为m-4
B.XY3的晶体一定是离子晶体
C.X与Y可能属同一周期,也可能分属不同周期
D.X原子半径大于Y原子的半径
8.N-H键能的含义是( )
A.由N和H形成1 mol NH3所放出的热量
B.把1 mol NH3的键全部拆开所吸收的热量
C.拆开6.02×1023个N-H键所吸收的能量
D.形成1个N-H键所放出的热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com